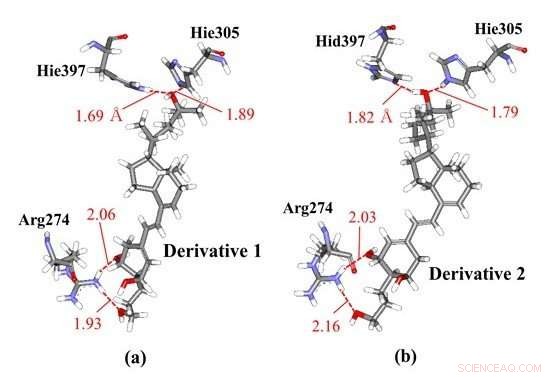
Interazioni del legame idrogeno tra derivati della vitamina D e residui di amminoacidi in VDR; (a) derivata 1 e (b) derivata 2 che hanno le stesse strutture chimiche ma chiralità diverse. Le nostre simulazioni molecolari ab initio hanno dimostrato che il derivato 1 interagisce con Hie397 e Hie305, mentre il derivato 2 interagisce con diversi residui di istidina protonata, come Hid397 e Hie305, indicando che la differenza di chiralità dei derivati può indurre cambiamenti negli stati di protonazione dell'istidina della proteina VDR. Credito:Toyohashi University of Technology
Ricercatori della Toyohashi University of Technology, in collaborazione con i ricercatori della Teijin Pharma Ltd. e della Teikyo University, hanno evidenziato la possibilità che la chiralità dei derivati della vitamina D possa influenzare gli stati di protonazione dei residui di istidina nella proteina del recettore della vitamina D tramite simulazioni molecolari ab initio e analisi biomediche. Questa scoperta sottolinea che gli stati di protonazione dovrebbero essere considerati più precisamente nelle simulazioni molecolari, quando si studiano interazioni specifiche tra farmaci candidati e proteine bersaglio correlate alla patogenesi della malattia.
La vitamina D svolge molti ruoli importanti nell'insorgenza di malattie immunologiche, così come la regolazione dei livelli di calcio nel sangue. Queste azioni fisiologiche causate dalla vitamina D attiva sono innescate dall'interazione specifica della vitamina D attiva con il recettore della vitamina D (VDR); molti tipi di derivati della vitamina D sono stati sviluppati come potenti ligandi contro VDR. È stato riportato che l'affinità di legame tra VDR umano e derivati della vitamina D dipende in modo significativo dalla chiralità del derivato.
Però, il motivo della dipendenza non è stato chiarito, che lo rende un collo di bottiglia nello sviluppo di nuovi e potenti farmaci contro le malattie immunologiche, il cui esordio è correlato all'attivazione del VDR.
Ora, ricercatori del Dipartimento di Informatica e Ingegneria della Toyohashi University of Technology e della Teijin Pharma Ltd. e della Teikyo University hanno dimostrato la possibilità della chiralità del derivato della vitamina D di influenzare gli stati di protonazione dei residui di istidina nella proteina VDR in base ai risultati valutata da simulazioni molecolari all'avanguardia e dal computer K di RIKEN.
I ricercatori hanno osservato le interazioni specifiche tra VDR e alcuni derivati della vitamina D con diverse chiralità utilizzando calcoli ab initio dell'orbitale molecolare del frammento (FMO). I risultati dell'FMO rivelano che due residui di istidina nel VDR contribuiscono in modo significativo al legame del VDR con i derivati e che gli stati di protonazione di questi residui possono influenzare le interazioni specifiche. Perciò, i ricercatori hanno considerato gli altri possibili stati di protonazione di questi residui di istidina e hanno determinato gli stati più stabili utilizzando i calcoli FMO ab initio. I risultati illustrati, per la prima volta, la possibilità che la differenza nelle chiralità dei derivati della vitamina D possa indurre cambiamenti negli stati di protonazione dei residui di istidina nel VDR che esiste vicino al derivato. A causa di questo cambiamento nello stato di protonazione, i derivati possono legarsi più fortemente al VDR e possono quindi produrre complessi più stabili con esso.
Questa scoperta fornisce un avvertimento importante ed essenziale per le simulazioni molecolari per considerare più precisamente gli stati di protonazione dei residui di istidina nelle proteine mentre si studiano le interazioni specifiche tra proteine e ligandi.
"Abbiamo utilizzato sofisticate simulazioni molecolari e il computer K per scoprire che gli stati di protonazione dei residui di istidina nel VDR cambiano significativamente con le alterazioni della chiralità del ligando, " spiega il Professore Associato Noriyuki Kurita, "Poiché esistono residui di istidina in molte proteine coinvolte nella patogenesi delle malattie, dovremmo considerare i loro stati di protonazione in modo più preciso tramite la progettazione di farmaci in silico basata su simulazioni molecolari".
Il primo autore, studente laureato Yuta Terauchi, disse, "Our final goal is to develop novel and potent drugs capable of activating VDR based on our ab initio molecular simulations, as well as on the basis of biomedical studies performed by our collaborators."
The authors are participating in an in silico drug design consortium—the fragment molecular orbital drug design (FMODD) consortium—in which various researchers from universities, drug companies, and national institutes are investigating the specific interactions between disease-related proteins and many types of candidate drugs using ab initio molecular simulations based on the FMO method and the K computer. Similar molecular simulations are underway now for a huge number of vitamin D derivatives in order to propose novel ligands for VDR, which can act as candidate for potent drugs against immunological diseases, such as cancer.