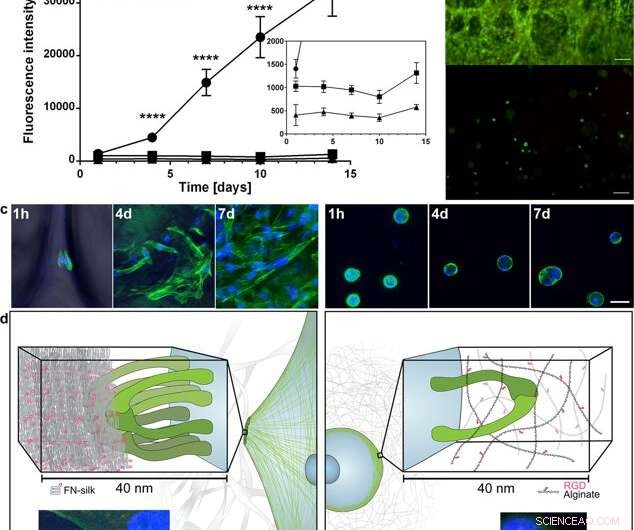
Diffusione ed espansione delle cellule all'interno della seta FN rispetto a quando incapsulate in un idrogel accoppiato a RGD. (a) Grafico rappresentativo (media e deviazione standard) del saggio di vitalità Alamar Blue che mostra l'attività metabolica dei fibroblasti (HDF) all'interno della schiuma di seta FN (cerchio), un idrogel di alginato a bassissima viscosità (VLVG) accoppiato con RGD (quadrato), e un idrogel di alginato a media viscosità (MVG) accoppiato con RGD (triangolo) durante due settimane di coltura. Inserisci mostra una vista ingrandita delle intensità inferiori. Statistiche (test t degli studenti in ogni momento):**** indica p < 0,0001 (n = 12) (b) Colorazione rappresentativa viva (verde) e morta (rossa) di cellule staminali mesenchimali umane (HMSC) in FN- schiuma di seta (superiore) e alginato accoppiato RGD VLVG (inferiore) al giorno 14. Barre di scala = 100 µm. (c) Scansioni confocali di HMSC integrate nella schiuma di seta FN (pannello sinistro), e idrogel di alginato accoppiato RGD MVG (pannello di destra) dopo 1 h, 4 giorni e 7 giorni. I filamenti di actina vengono visualizzati mediante colorazione con falloidina (verde) e i nuclei cellulari vengono colorati con DAPI (blu). Barre di scala = 20 µm. (d) Descrizione schematica dell'ipotesi per il motivo alla base della differenza osservata nelle interazioni tra cellule e seta (a sinistra) rispetto agli idrogel di alginato accoppiati a RGD (a destra). Diverse coppie di integrine (verdi) possono aderire e riunirsi alle microfibre di seta, formazione di aderenze focali sul bordo dei filamenti di actina, permettendo alle cellule di diffondersi e proliferare. Nell'idrogel di alginato, una singola coppia di integrine (verde) può legarsi al motivo RGD accoppiato, ma le sottili catene di alginato limitano la successiva raccolta in aderenze focali. Gli inserti mostrano esempi di una cellula (fibroblasto) dopo 3 h in schiuma di seta FN (a sinistra) e un idrogel di alginato a bassa viscosità (VLVG) accoppiato con RGD (a destra). I filamenti di actina sono visualizzati mediante colorazione con falloidina (verde), e aderenze focali possono essere viste dove questo è co-localizzato con colorazione per vinculina (rosso, contrassegnato con freccia). I nuclei cellulari sono colorati con DAPI (blu). Credito:rapporti scientifici, doi:10.1038/s41598-019-42541-y
I tessuti biologici vengono costruiti quando le cellule si ancorano a siti specifici su una rete di microfibre 3D in una matrice extracellulare (ECM). Gli scienziati sono desiderosi di ricreare i tessuti biologici in laboratorio utilizzando l'ingegneria dei tessuti bioispirata e l'ingegneria genetica, per formare motivi ECM funzionali fusi con proteine della seta ricombinanti. In condizioni fisiologiche adeguate, le proteine della seta bioingegnerizzate e la fibronectina-seta (FN-seta) possono autoassemblarsi in reti di microfibra che imitano l'ECM nativo.
In un recente studio, Ulrika Johansson, Mona Widhe e collaboratori dei dipartimenti interdisciplinari di Biotecnologie, Chimica dei biomateriali, e Immunology in Svezia hanno sviluppato un metodo per includere cellule di mammifero in una soluzione di seta prima di assemblare la seta in costrutti, per formare microfibre simili a tessuti uniformi e integrate nelle cellule. I costrutti di scaffold 3D risultanti hanno mostrato una migliore proliferazione cellulare (crescita) e una diffusione omogenea delle cellule rispetto alle cellule incapsulate nell'idrogel. I risultati dello studio sono ora pubblicati in Rapporti scientifici .
Gli scienziati hanno confermato l'attaccamento cellulare su costrutti fibronectina-seta (FN-Silk) nel lavoro osservando l'actina filamentosa e definendo i punti di adesione focali dell'allegato, cellule allungate. Hanno mantenuto la vitalità cellulare per 90 giorni nelle superfici cellula-FN/seta e hanno mostrato la scalabilità del metodo per colture cellulari 3-D di dimensioni macro. I fasci di microfibra di seta con cellule incapsulate hanno mantenuto la forza biomeccanica e l'estensibilità proprio come le pareti delle arterie umane.
Il protocollo sviluppato da Johansson e Widhe et al. ha anche permesso alle cellule staminali di differenziarsi all'interno dei costrutti 3-D per assistere la crescita di diverse co-culture cellulari. Hanno dimostrato che le cellule endoteliali potrebbero essere incluse nei materiali bioispirati per formare strutture simili a vasi in tutti i costrutti tissutali. Gli scienziati prevedono di utilizzare la rete simile all'ECM come base per gli sforzi futuri volti a progettare tessuti biologici funzionali in laboratorio.
La coltura di cellule di mammifero in vitro è una tecnica sperimentale indispensabile nella ricerca di base e nelle applicazioni industriali, sebbene il processo esistente si basi su plastica dura 2-D o superfici di vetro per comodità, compromettendo la risposta biologica nativa. Poiché le cellule biologiche sono naturalmente abituate a ricevere segnali dall'ambiente 3-D, gli ingegneri dei tessuti hanno formato nuove strategie sperimentali utilizzando colture cellulari 3D. Le condizioni sperimentali hanno mantenuto l'adesione cellulare, proliferazione e differenziazione per ricreare e sostenere il metabolismo e la funzionalità cellulare in laboratorio.
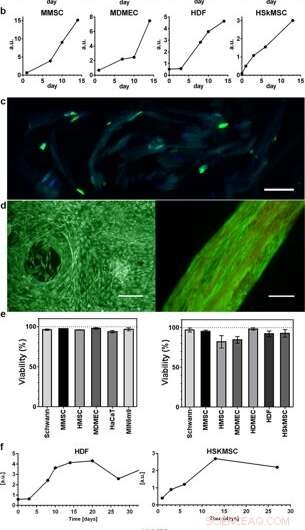
Proliferazione e vitalità delle cellule integrate nella seta 3D. Grafici rappresentativi del saggio di vitalità del blu Alamar mostrano un aumento dell'attività metabolica durante le prime 2 settimane all'interno di (a) schiuma (N = 3–4, n = 3–7), e (b) fibre (N = 1–9, n = 2–13), che riflette la crescita dei vari tipi di cellule integrate (HaCaT; linea cellulare di cheratinociti umani, HDF; fibroblasti dermici umani, MDMEC; cellule endoteliali microvascolari dermiche di topo, MIN6m9;linea -cellula pancreatica di topo secernente insulina). (c) La divisione cellulare avviene in profondità all'interno della seta 3D. Criosezione di una fibra con fibroblasti integrati (HDF) fissata al giorno 11 e colorata con FITC-anti BrdU per DNA di nuova sintesi (verde) e DAPI (blu). La seta mostra una debole autofluorescenza nella gamma blu/verde. (d) Colorazione rappresentativa viva (verde) e morta (rossa) di cellule staminali mesenchimali di topo (MMSC) in schiuma (a sinistra) e HDF in fibra (a destra) al giorno 14. La fibra mostra una debole autofluorescenza nell'intervallo rosso. Barre di scala = 100 µm. (e) redditività (%, media e deviazione standard) dopo 14 giorni di coltura di diversi tipi di cellule (vedi Suppl. Tabella 1) in schiuma (grafico a sinistra), e nelle fibre (grafico a destra) (N = 1–3, n = 4). (f) Colture a lungo termine di cellule integrate in fibre hanno mantenuto l'attività metabolica (Alamar blue) durante l'intero periodo di studio (fino a 97 giorni). Credito:rapporti scientifici, doi:10.1038/s41598-019-42541-y
In precedenza, Johansson e Widhe et al. aveva sviluppato un processo scalabile per ingegnerizzare la proteina della seta di ragno ricombinante nota come 4RepCT per la coltura cellulare bioispirata in laboratorio, che si autoassemblano in microfibre biodegradabili e biocompatibili in soluzione acquosa, tamponi fisiologici a temperatura ambiente. Hanno funzionalizzato il nuovo costrutto utilizzando un motivo di adesione cellulare dalla fibronectina (FN) per formare il materiale di seta FN e promuovere un solido attaccamento cellulare. Sebbene le cellule proliferassero lungo le nuove superfici del materiale, rimasero soli in superficie, incapace di proliferare nei costrutti per imitare adeguatamente le proprietà simili ai tessuti in vitro. Nel presente lavoro, gli scienziati hanno quindi sviluppato un nuovo metodo, per incorporare in modo efficiente le cellule nel materiale di seta durante l'assemblaggio di seta FN per colture cellulari 3D incapsulate e vitali che imitavano adeguatamente la matrice extracellulare in vitro.
Costrutti di seta incorporati nelle cellule di ingegneria tissutale in laboratorio
Durante gli esperimenti, Johansson e Widhe et al., prima ha aggiunto una goccia di cellule staminali disperse (cellule staminali mesenchimali di topo, MMSC) alla soluzione proteica FN-seta prima dell'assemblaggio della soluzione. Dopo l'incubazione, la rete appena formata è rimasta stabile nei terreni di coltura e il numero di cellule incapsulate è aumentato nei costrutti durante il periodo di coltura. Dopo tre giorni, le cellule si diffondono su tutte le dimensioni della schiuma, che gli scienziati hanno osservato utilizzando la microscopia a contrasto di interferenza differenziale (DIC).
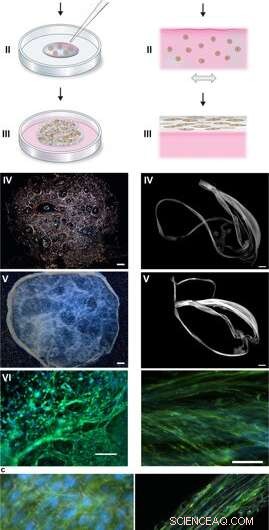
Assemblaggio della seta per integrare le cellule in una rete 3D di microfibre. (a) Descrizione schematica della formazione di schiuma di seta con cellule radicate. Le cellule sospese nel mezzo di coltura (rosa) vengono aggiunte a una goccia definita di soluzione di proteine della seta FN (blu) posta al centro di un pozzetto di coltura non trattato (I). Le bolle d'aria vengono introdotte rapidamente (5–10 sec) attraverso un puntale di pipetta (II), per dare origine a una schiuma 3D con cellule. Dopo 30 minuti nell'incubatrice cellulare, viene aggiunto ulteriore terreno di coltura per coprire completamente la schiuma (III). Giorno 1 dopo la formulazione, la schiuma di seta con cellule sembra quasi trasparente, pur ospitando alcune bolle d'aria residue (che scompaiono con il tempo) (IV). Dopo 2 settimane di coltura, la schiuma a cellule integrate mostra un aspetto più denso e più bianco (V). Già al giorno 3 la schiuma è riempita con cellule ben distribuite (qui sono mostrate cellule staminali mesenchimali di topo (MMSC)) (VI). I filamenti di actina sono visualizzati dalla falloidina (verde) e i nuclei cellulari dalla colorazione DAPI (blu). Barra della scala IV-V = 1 mm, VI = 100 µm. (b) Descrizione schematica delle fibre di seta formate con celle integrate. Le cellule sospese nel mezzo (rosa) vengono aggiunte alla soluzione proteica FN-seta (blu) (I). Durante un'inclinazione uniassiale ripetuta e delicata per 1-3 ore (II) le proteine della seta si assemblano all'interfaccia aria-liquido in un fascio macroscopico di microfibre con cellule incorporate (III). Le fibre di seta con cellule sono facilmente recuperabili (IV) e possono essere poste in un pozzo per ulteriore coltura, per cui lo spessore aumenta in 2 settimane (V). Al giorno 3, le cellule allineate (qui MMSC) si trovano sparse integrate nel fascio di fibre (VI). I filamenti di actina sono visualizzati dalla falloidina (verde) e i nuclei cellulari dalla colorazione DAPI (blu). Barra della scala IV-V = 1 mm, VI = 100 µm. (c) Micrografie a contrasto di interferenza differenziale (DIC) delle microfibre di seta (bianche) in una fibra (a sinistra) e una schiuma (a destra) con celle integrate (MMSC). I filamenti di actina sono visualizzati dalla falloidina (verde) e i nuclei cellulari dalla colorazione DAPI (blu). Barra della scala = 50 µm (sinistra) e 100 µm (destra). Credito:rapporti scientifici, doi:10.1038/s41598-019-42541-y
Hanno diretto l'allineamento cellulare per formare una rete 3D casuale di microfibre che imitava con successo i tessuti biologici formando un fascio macroscopico di microfibre durante la linea temporale della coltura cellulare, seguito dall'esame del rapporto tra cellule e ECM. Gli scienziati hanno variato l'ECM in base alla composizione cellulare per imitare o abbinare una gamma di tipi di tessuto, compresi i tessuti del fegato radi e ad alta densità. Il metodo è quindi adatto anche per la coltura cellulare 3D con quantità di cellule minuscole.
Testare la vitalità cellulare sugli scaffold di seta - studi di citocompatibilità
Gli scienziati hanno utilizzato i profili di crescita per mappare i diversi tipi di cellule incorporati sia nella schiuma che nelle fibre dell'assemblaggio della seta. Hanno osservato un aumento del segnale dall'attività metabolica per rappresentare la proliferazione cellulare negli scaffold di seta 3-D e nel tempo hanno mostrato un aumento della densità cellulare nello scaffold di seta cellulare più interno. Johansson et al. ha studiato la proliferazione cellulare utilizzando la colorazione BrdU, dove i risultati positivi hanno dimostrato una proliferazione più profonda e una diffusione cellulare nelle fibre di seta per mantenere la vitalità cellulare dopo 2 settimane di incapsulamento, e durante periodi di coltura cellulare a lungo termine che duravano da uno a tre mesi.
Confrontando la citocompatibilità della seta rispetto ai biomateriali idrogel
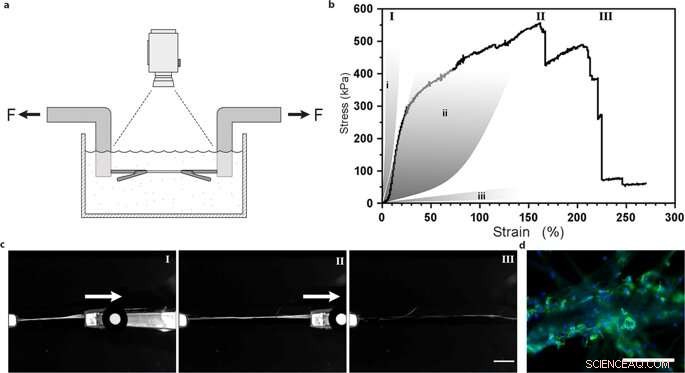
Test di trazione uniassiale di fibre di seta con cellule staminali mesenchimali integrate. (a) Illustrazione del set-up sperimentale per prove di trazione eseguite in tampone PBS a 37 °C al fine di mantenere le cellule vitali. (b) Rappresentante Primo stress Piola-Kirchhoff rispetto alla curva di deformazione di una fibra di seta FN con cellule staminali mesenchimali integrate (MMSC) sottoposta a test di trazione dopo 14 giorni di coltura. La curva sforzo-deformazione illustra una fase piuttosto lineare (e probabilmente elastica) che è seguita da una fase di deformazione di tipo plastico (irreversibile) fino al raggiungimento della massima sollecitazione, e la fibra si rompe. Per confronto, le aree grigie rappresentano intervalli di proprietà di deformazione da sforzo nei tendini e nei legamenti (i), pareti delle arterie (ii), e tessuto cerebrale (iii). I numeri romani si riferiscono alle immagini (c) scattate durante la prova di trazione, cioè durante l'avvio (I), estensione (II) e rottura (III) delle fibre. Barra della scala = 5 mm. (d) Micrografie del punto di rottura delle fibre con MMSC dopo prove di trazione. I filamenti di actina vengono visualizzati mediante colorazione con falloidina (verde) e i nuclei cellulari vengono colorati con DAPI (blu). Barre di scala = 200 µm. Credito:rapporti scientifici, doi:10.1038/s41598-019-42541-y
Sulla base degli incoraggianti risultati preliminari, gli scienziati hanno condotto esperimenti paralleli per confrontare la crescita cellulare nella seta con la crescita cellulare nell'idrogel per determinare la citocompatibilità dei due materiali. Hanno scelto l'alginato per rappresentare l'idrogel durante la coltura cellulare e hanno osservato differenze tra alginato e seta, registrazione dell'espansione delle cellule chiare nella seta, mentre le cellule in alginato sono rimaste in uno stato metabolico costante. Utilizzando la microscopia confocale, hanno studiato le ragioni della differenza osservata nella crescita cellulare a livello del microambiente. I risultati hanno mostrato un rapido attaccamento cellulare (visto con cellule allungate) nei costrutti di seta, mentre i costrutti di alginato si sono contratti durante la coltura cellulare, che potrebbe aver sollecitato il distacco delle cellule.
Studi biomeccanici – caratterizzazione dei nuovi materiali
Hanno determinato che la rigidità della superficie del materiale è un componente cruciale che ha influenzato il destino delle cellule. Per verificare questa osservazione, Johansson et al. testato il comportamento biomeccanico dei costrutti di seta per garantire che imitassero adeguatamente il tessuto nativo. Hanno condotto prove di trazione in un tampone fisiologico per ottenere i risultati, che ha dimostrato che le proprietà meccaniche delle cellule contenenti seta corrispondevano a quelle del tessuto connettivo come le pareti arteriose. Johansson et al. sono stati in grado di dimostrare un'elevata estendibilità delle microfibre per indicare la transizione della forza all'interno e attraverso le cellule attaccate al nuovo biomateriale, confermando un adeguato attaccamento cellulare.
Studi di biofunzionalizzazione:indagine sulla biocompatibilità superficiale in vitro
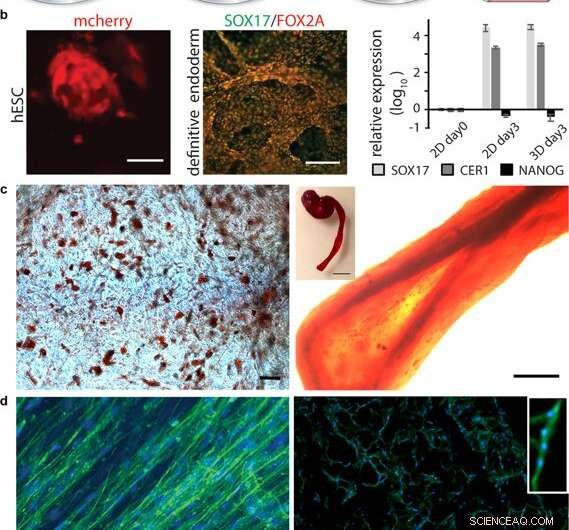
Differenziazione di cellule in seta 3D. (a) Dopo l'espansione iniziale delle cellule staminali integrate nella seta 3D, la differenziazione in vari tipi di tessuto può essere innescata dall'aggiunta di fattori appropriati. (b) Differenziazione delle cellule staminali pluripotenti. A sinistra:cellule staminali embrionali umane (hESC) visualizzate mediante rilevamento mCherry a 48 h dopo l'integrazione cellulare nella schiuma di seta FN. Barra della scala = 50 µm. Al centro:immunocolorazione per i marcatori endodermici SOX17 (verde) e FOX2A (rosso) dopo 3 giorni di differenziazione. Barre di scala = 200 µm. A destra:espressione genica (SOX17, CER1, NANOG) di hESC in una schiuma di seta FN rispetto alla coltura 2D, analizzato mediante RT-qPCR al giorno 3 di induzione endodermica. Le barre rappresentano la variazione di piegatura media ± deviazione standard (n = 4). (c) Differenziazione di cellule staminali adulte multipotenti. A sinistra:cellule staminali mesenchimali umane (HMSC) in schiuma di seta FN differenziate nel lignaggio adipogenico contenente lipidi, visualizzato dalla colorazione Red Oil (rosso) (N = 2, n = 4). Barra della scala = 100 µm. A destra:HMSC differenziate nel lignaggio osteogenico, sondato con marcatore osteogenico per il contenuto di calcio (Alizarin Red S (rosso) in fibra di seta FN (a destra, scala bar = 200 µm), (N = 2, n = 4). L'inserto mostra la foto di un'intera fibra (a destra), scala bar = 1 mm). (d) Differenziazione delle cellule precursori adulte. A sinistra:dopo 14 giorni nei terreni di differenziazione, le cellule satellite del muscolo scheletrico (HSkMSC) all'interno di una fibra di seta FN mostrano filamenti di actina prominenti, come visualizzato dalla colorazione con falloidina (verde). A destra:differenziazione miogenica delle cellule satellite del muscolo scheletrico (HSkMSC) visualizzata mediante colorazione con Desmina (verde). Nuclei colorati con DAPI in blu. (N = 9, n = 4). Barre di scala = 200 µm. Un primo piano dell'area di un miotubo multinucleato è mostrato nell'angolo in alto a destra. Credito:rapporti scientifici, doi:10.1038/s41598-019-42541-y
Dopo aver stabilito la stabilità biomeccanica, gli scienziati hanno testato se le cellule staminali cresciute sulle impalcature di seta potessero differenziarsi (mature) sullo stesso materiale. Per questo, hanno usato cellule staminali embrionali umane pluripotenti e multipotenti nei saggi di coltura cellulare, seguita dalla quantificazione dell'espressione genica di marcatori biologici della crescita cellulare; FOXA2 (geni metabolici), SOX17 (geni per lo sviluppo embrionale e la determinazione del destino cellulare), CER1 (antagonisti delle proteine morfogenetiche ossee) e NANOG (proliferazione delle cellule staminali embrionali, pluripotenza e rinnovamento). Nei risultati, sia SOX17 che CER1 hanno mostrato una robusta sovraregolazione, mentre il biomarcatore di pluripotenza (NANOG) è diminuito a causa della maturità cellulare a causa della perdita di pluripotenza.
Gli scienziati hanno testato la biofunzionalizzazione della superficie per diversi tipi di cellule, comprese le cellule satellite del muscolo scheletrico umano (HSkMSC) e le cellule staminali mesenchimali umane derivate dal midollo osseo (hMSC). Dopo l'espansione cellulare sui costrutti, gli scienziati potrebbero indirizzare il destino delle hMSC in linee cellulari adipogeniche o osteogeniche. Inoltre, dopo due settimane di coltura cellulare, Johansson et al. hanno mostrato una differenziazione miogenica delle HSkMSC per formare filamenti di actina prominenti, ed esprimere il marcatore muscolo-specifico desmina, per verificare la maturazione del miotubo in vitro.
Progettazione di vasi biologici in laboratorio
Gli scienziati hanno quindi combinato le cellule endoteliali nella rete vascolare 3D per formare tessuto connettivo che imitava l'organizzazione cellulare intrinseca dei microvasi in laboratorio. Hanno seguito lo stesso protocollo utilizzando l'assemblaggio della seta con l'integrazione cellulare e hanno aggiunto una frazione di cellule endoteliali per ingegnerizzare il tessuto connettivo. In due settimane, hanno osservato che le cellule si raccolgono e formano germogli ramificati lunghi millimetri e strutture simili a vasi con anelli prominenti di cellule endoteliali nelle fibre di seta. Gli scienziati potrebbero aumentare le dimensioni dei costrutti in scala e determinare l'allineamento e l'aggregazione di diversi tipi di cellule.
In questo modo, Johansson e Widhe et al. ha dimostrato una nuova strategia e sviluppato un protocollo per adattarsi alle cellule funzionali all'interno di reti 3D che imitavano l'architettura fibrosa della matrice extracellulare nativa (ECM). Per mediare l'esperimento, hanno utilizzato proteine della seta ricombinanti autoassemblanti e hanno dimostrato che una varietà di cellule potrebbe essere incorporata nei costrutti 3D. La configurazione e il protocollo sono semplici ed economici, a differenza della stampa 3D, il processo è frugale e pratico, senza macchinari costosi. Gli scienziati mirano a ottimizzare e standardizzare questo protocollo per sviluppare biocompatibilità, materiali di seta avanzati nell'ingegneria dei tessuti. Il lavoro sperimentale avrà un'ampia gamma di applicazioni nella scienza dei materiali come modelli in miniatura in vitro per lo sviluppo di farmaci e come costrutti di tessuti bioingegnerizzati più grandi nella medicina rigenerativa.
© 2019 Scienza X Rete