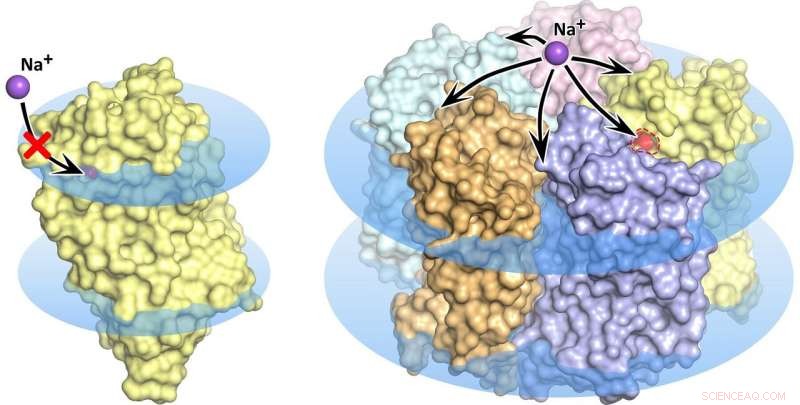
KR2 rodopsina monomero (a sinistra) e pentamero (a destra) nella membrana cellulare, mostrato come dischi blu. Nello stato monomerico, il trasporto del sodio è bloccato, il poro arancione non consente l'assorbimento di ioni nella proteina. Credito:Kirill Kovalev et al./ Progressi scientifici
Un team di biofisici dalla Russia, Germania, e Francia, con ricercatori dell'Istituto di fisica e tecnologia di Mosca, ha scoperto e studiato la struttura della rodopsina KR2 in condizioni fisiologiche. Questo lavoro pionieristico apre il terreno per una futura svolta nell'optogenetica, un'area altamente rilevante della biomedicina con applicazioni nel trattamento delle malattie neurologiche e altro ancora. La scoperta fondamentale porterà a un nuovo strumento per una terapia efficace della depressione, disturbi d'ansia, epilessia, e il morbo di Parkinson. Il documento che riporta lo studio è stato pubblicato in Progressi scientifici .
L'optogenetica è un'area completamente nuova della biofisica e delle tecniche di esplorazione della biomedicina per il controllo delle cellule nervose e muscolari in un organismo vivente tramite segnali luminosi. Non molto tempo fa, la principale rivista di ricerca Scienza ha salutato l'optogenetica come la "svolta del decennio". I metodi optogenetici consentono già un parziale recupero della vista persa, udito, e il controllo muscolare compromesso da una malattia neurologica. È importante sottolineare che queste tecniche consentono ai ricercatori di studiare in dettaglio le reti neurali. Questo non si riferisce alle reti di computer ma a quelle ospitate nel cervello umano e responsabili delle nostre emozioni, il processo decisionale, e altri processi fondamentali.
Diversi anni fa, i ricercatori hanno scoperto un nuovo tipo di trasportatore di ioni, la rodopsina KR2, nella membrana cellulare del batterio marino Krokinobacter eikastus. La nuova proteina trovata è sensibile alla luce, rendendolo utile per optogenetica. Spinto dalla luce, tali proteine possono facilitare la traslocazione di particelle cariche come gli ioni attraverso la membrana cellulare. Introducendo tali trasportatori nella cellula, i ricercatori possono quindi utilizzare impulsi luminosi per manipolare il potenziale della membrana cellulare del neurone, controllando la sua attività. È stato dimostrato che KR2 trasporta selettivamente un particolare tipo di particelle, gli ioni di sodio, all'esterno della cellula. Piuttosto che permettere il passaggio di questi ioni in entrambe le direzioni, la proteina svolge il trasporto attivo, fungendo da "pompa". Anche le forme mutanti di KR2 hanno mostrato attività di pompaggio del potassio. Impiantando queste pompe nella membrana cellulare, l'intero ambito dell'attività dei neuroni potrebbe teoricamente essere controllato.
L'ondata di ricerche che ha seguito la scoperta della nuova pompa molecolare ha affrontato alcune proprietà piuttosto misteriose della rodopsina. Diversi gruppi di ricerca hanno scoperto e descritto un totale di cinque diverse strutture della promettente proteina. In particolare, in alcune di queste strutture cinque molecole di KR2 formano un pentamero stabile, mentre in altri è presente solo il monomero proteico (figura 1).
"Quindi la domanda drammatica era:quale di queste strutture dovrebbe essere considerata quella giusta?" ha detto lo studente di dottorato del MIPT Kirill Kovalev, un autore principale dello studio. "Infatti, le strutture si sono rivelate abbastanza simili, ma il diavolo è nei dettagli, che determinano le possibili applicazioni della proteina nella scienza e nella pratica clinica".
Guidato dai biofisici del MIPT, il team ha scoperto cosa dà origine alla confusa varietà di strutture proteiche. Si è scoperto che i gruppi di ricerca che studiavano KR2 avevano cristallizzato la proteina in condizioni diverse. La proteina unica è originariamente prodotta da un batterio oceanico originario di un ambiente molto speciale. Vive in acque con una salinità specifica, acidità, e concentrazione di ioni idrogeno (pH). Queste condizioni sono un prerequisito affinché la proteina faccia ciò che i ricercatori si aspettano che faccia, cioè pompare ioni sodio, formando anche pentameri nella membrana cellulare. Le numerose strutture "false" della proteina si sono rivelate artefatti di cristallizzazione o corrispondono solo alle condizioni che disabilitano virtualmente l'attività di pompaggio del sodio di KR2, che lo rende molto attraente per la comunità optogenetica globale.
"Per la prima volta, abbiamo simulato le condizioni fisiologiche per l'esistenza e il funzionamento di KR2. Di conseguenza, abbiamo ottenuto la struttura 'corretta' della nuova proteina, che corrisponde al suo stato originario. Abbiamo dimostrato che l'unità funzionale della proteina è un pentamero, " ha spiegato Valentin Gordeliy dell'Istituto di Biologia Strutturale di Grenoble. "Inoltre, abbiamo trovato una spiegazione per le contraddizioni tra i precedenti studi strutturali della proteina".
La rodopsina KR2 è rivoluzionaria per l'optogenetica, e conoscerne la corretta struttura in condizioni fisiologiche è fondamentale sia per comprendere i meccanismi alla base del suo funzionamento, sia per esplorare il sistema nervoso modellando nuovi strumenti optogenetici e applicandoli nella pratica medica.