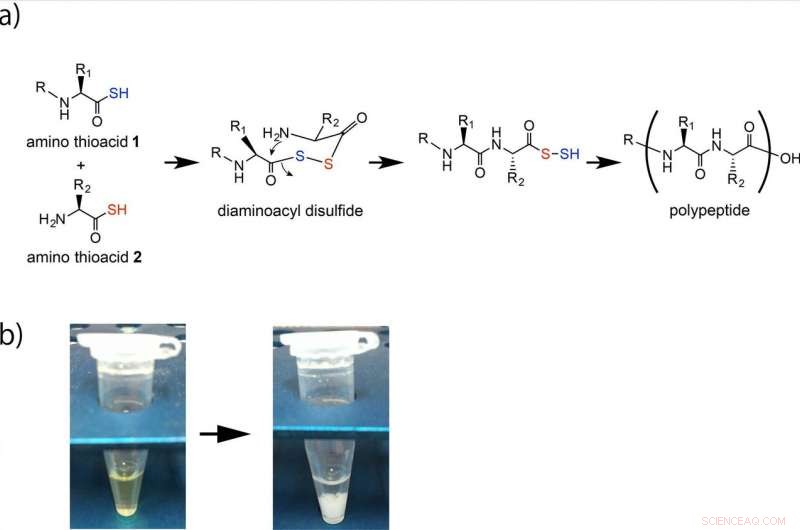
Formazione di polipeptidi per reazione ossidativa degli ammino tioacidi. (a) Gli ammino tioacidi 1 e 2 sono accoppiati tramite un intermedio diaminoacil disolfuro e la successiva formazione di ammidi intramolecolari genera un legame alfa-ammidico. Il minerale di ferro o Fe2O3 in soluzione acida accelera questa formazione di polipeptidi. Le prestazioni ripetitive di questa reazione producono il polipeptide. (b) Il polipeptide si forma come un precipitato bianco. Credito:Università di Osaka
I principali costituenti delle cellule, fazzoletto di carta, organi, e gli organismi interi sono proteine, che sono costruiti dall'aggiunta di amminoacidi uno dopo l'altro per formare lunghe catene proteiche chiamate polipeptidi. Sebbene le cellule viventi dispongano di macchinari avanzati in grado di ottenere questa estensione della catena con velocità e precisione sorprendenti, gli sforzi per imitare questa reazione in laboratorio al fine di creare prodotti peptidici naturali o farmaci peptidici sono rimasti rozzi e laboriosi al confronto.
Utilizzando varianti di amminoacidi chiamati ammino tioacidi, un team dell'Università di Osaka ha superato queste difficoltà per ottenere l'estensione accurata e semplice delle catene peptidiche in una reazione rapida. Il loro lavoro, pubblicato sulla rivista Biochimica , suggerisce anche che, miliardi di anni fa, questo particolare meccanismo chimico avrebbe potuto consentire la comparsa di un'abbondanza di molecole più grandi e complesse, potenzialmente fornendo le condizioni dalle quali alla fine è sorta la vita.
In questo studio, il team si è concentrato sul miglioramento degli sforzi precedenti per sintetizzare artificialmente i polipeptidi, in cui un ostacolo maggiore era la necessità di includere gruppi protettivi. Tali gruppi protettivi vengono aggiunti ai gruppi funzionali all'interno di una molecola per garantire che una reazione successiva sia specifica. Però, richiedono più fasi di reazione per essere eseguite, che rende la procedura inefficiente.
"Nei nostri sforzi per migliorare la formazione artificiale del legame peptidico, piuttosto che concentrarsi sugli amminoacidi, abbiamo invece esaminato gli ammino tioacidi, che includono un atomo di zolfo, " Dice Yasuhiro Kajihara. "Abbiamo iniziato con la versione amminotioacidica della fenilalanina come monomero, e in una reazione della durata di soli cinque minuti ha scoperto che si formavano catene peptidiche contenenti da due a cinque fenilalanine. Un'analisi alternativa ha rivelato catene lunghe fino a 12 fenilalanine".
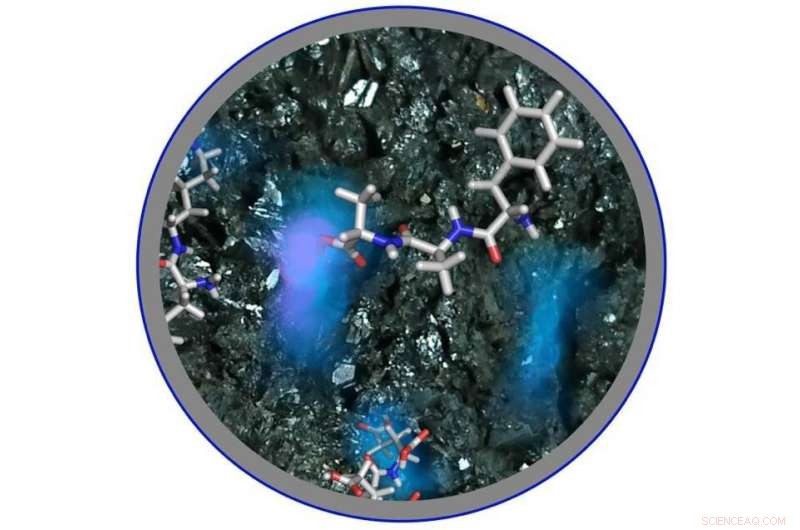
Un'immagine della formazione di polipeptidi da parte degli ammino tioacidi sulla superficie del minerale di ferro in soluzione acida. Credito:Università di Osaka
Il team ha quindi dimostrato che l'estensione della catena peptidica si è verificata con miscele di amino tioacidi e anche solo in condizioni acide, che suggeriva che l'ossidazione fosse la chiave del meccanismo coinvolto. Il team lo ha confermato caratterizzando la reazione, e ha anche mostrato che coinvolgeva un unico intermedio di reazione, che ha assicurato che il prodotto previsto è stato generato con precisione.
"Dato che l'estensione degli amminoacidi regolari in catene è un fattore chiave per la vita, ci siamo chiesti se, miliardi di anni fa, gli ammino tioacidi potrebbero aver agito come precursori della chimica più complessa che ha portato allo sviluppo della vita senziente, vista la loro rapida e semplice incorporazione nelle catene, ", afferma l'autore principale Ryo Okamoto. "Abbiamo scoperto che la reazione di oligomerizzazione procedeva anche in condizioni chimiche simili a quelle sulla Terra prima che nascesse la vita, utilizzando componenti di reazione come minerale di ferro e acido solforico, che potrebbe essere stato generato dal gas vulcanico."
Il lavoro del team fornisce quindi non solo uno strumento di laboratorio efficiente per una gamma di applicazioni pratiche, ma anche un potenziale assaggio della chimica da cui è iniziata la vita.