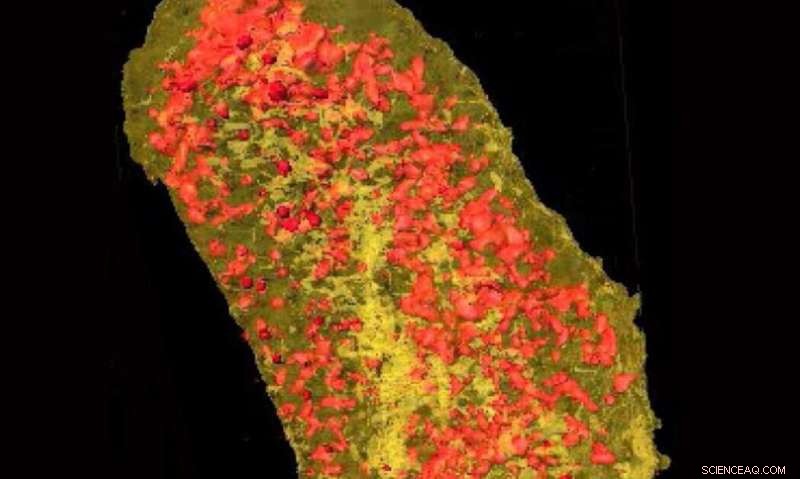
I raggi X ultraluminosi hanno rivelato la concentrazione di erbio (giallo) e zinco (rosso) in una singola cellula di E. coli che esprime un'etichetta legante i lantanidi e incubata con erbio. Credito:Brookhaven National Laboratory
Un team di scienziati, tra cui ricercatori del National Synchrotron Light Source II (NSLS-II), una struttura per gli utenti dell'Office of Science del Dipartimento dell'Energia degli Stati Uniti (DOE) presso il Brookhaven National Laboratory del DOE, ha dimostrato una nuova tecnica per l'imaging di proteine in 3-D con risoluzione su scala nanometrica. Il loro lavoro, pubblicato in Giornale della Società Chimica Americana , consente ai ricercatori di identificare la posizione precisa delle proteine all'interno delle singole cellule, raggiungendo la risoluzione della membrana cellulare e dei più piccoli organelli subcellulari.
"Nel mondo della biologia strutturale, gli scienziati utilizzano tecniche come la cristallografia a raggi X e la microscopia crioelettronica per conoscere la struttura precisa delle proteine e dedurre le loro funzioni, ma non impariamo dove funzionano in una cellula, " ha detto l'autore corrispondente e scienziato NSLS-II Lisa Miller. "Se stai studiando una particolare malattia, devi sapere se una proteina funziona nel posto sbagliato o non funziona affatto."
La nuova tecnica sviluppata da Miller e dai suoi colleghi è simile nello stile ai metodi tradizionali di microscopia a fluorescenza in biologia, in cui una molecola chiamata proteina fluorescente verde (GFP) può essere attaccata ad altre proteine per rivelare la loro posizione. Quando GFP è esposto ai raggi UV o alla luce visibile, emette un colore verde brillante, illuminando una proteina altrimenti "invisibile" nella cellula.
"Utilizzando GFP, possiamo vedere se una proteina si trova in strutture subcellulari di centinaia di nanometri, come il nucleo o il citoplasma, "Miller ha detto, "ma strutture come una membrana cellulare, che ha una dimensione di soli 7-10 nanometri, sono difficili da vedere con i tag a luce visibile come GFP. Per vedere strutture delle dimensioni di 10 nanometri in una cella, trai grande beneficio dall'uso dei raggi X."
Per vincere questa sfida, i ricercatori di NSLS-II hanno collaborato con scienziati del Massachusetts Institute of Technology (MIT) e della Boston University (BU) che hanno sviluppato un tag sensibile ai raggi X chiamato tag di legame ai lantanidi (LBT). Gli LBT sono proteine molto piccole che possono legarsi strettamente agli elementi della serie dei lantanidi, come l'erbio e l'europio.
"A differenza di GFP, che emette fluorescenza quando esposto ai raggi UV o alla luce visibile, i lantanidi diventano fluorescenti in presenza di raggi X, " ha detto l'autore principale Tiffany Victor, un ricercatore associato presso NSLS-II. "E poiché i lantanidi non si trovano naturalmente nella cellula, quando li vediamo con il microscopio a raggi X, conosciamo la posizione della nostra proteina di interesse."
I ricercatori di NSLS-II, MIT, e BU hanno lavorato insieme per combinare la tecnologia LBT con la fluorescenza a raggi X.
"Sebbene gli LBT siano stati ampiamente utilizzati nell'ultimo decennio, non sono mai stati usati per studi di fluorescenza a raggi X, " ha detto Miller.
I raggi X ultraluminosi hanno rivelato la concentrazione di erbio (giallo) e zinco (rosso) in una singola cellula di E. coli che esprime un'etichetta legante i lantanidi e incubata con erbio. Credito:Brookhaven National Laboratory
Oltre ad ottenere immagini ad alta risoluzione, La fluorescenza a raggi X fornisce simultaneamente immagini chimiche su tutti gli oligoelementi in una cellula, come il calcio, potassio, ferro da stiro, rame, e zinco. In altri studi, Il team di Miller sta studiando come gli oligoelementi come il rame siano collegati alla morte dei neuroni in malattie come l'Alzheimer. Visualizzare la posizione di questi elementi in relazione a proteine specifiche sarà la chiave per nuove scoperte.
Oltre alla loro compatibilità con i raggi X, Gli LBT sono anche utili per le loro dimensioni relativamente piccole, rispetto ai tag a luce visibile.
"Immagina di avere attaccata una coda grande quanto tutto il tuo corpo, o più grande, " Miller ha detto. "Ci sarebbero un sacco di normali attività che non saresti più in grado di fare. Ma se dovessi solo andare in giro con una piccola coda di maiale, potresti ancora correre, salto, e passare attraverso le porte. La GFP è come la coda grossa:può essere un vero impedimento alla funzione di molte proteine. Ma queste piccole etichette che legano i lantanidi sono quasi invisibili".
Per dimostrare l'uso di LBT per l'imaging di proteine in 3-D con risoluzione su scala nanometrica, i ricercatori del MIT e della BU hanno etichettato due proteine in una cellula batterica:una proteina citoplasmatica e una proteina di membrana. Quindi, Il team di Miller ha studiato il campione presso la linea di luce Hard X-ray Nanoprobe (HXN) presso NSLS-II e la linea di luce Bionanoprobe presso l'Advanced Photon Source (APS), una struttura per gli utenti dell'Office of Science del DOE presso l'Argonne National Laboratory del DOE.
"HXN offre la dimensione di messa a fuoco dei raggi X leader nel mondo, che scende a circa 12 nanometri. Questo è stato fondamentale per l'imaging della cellula batterica in 3-D con risoluzione su scala nanometrica, " ha detto Yong Chu, capo scienziato della linea di luce presso HXN. "Abbiamo anche sviluppato un nuovo modo di montare le celle su un supporto per campioni specializzato al fine di ottimizzare l'efficienza delle misurazioni".
Accoppiando la risoluzione senza pari di HXN con le capacità di LBT, il team è stato in grado di visualizzare entrambe le proteine etichettate. Visualizzando la proteina della membrana cellulare dimostrata, gli LBT possono essere visti ad alta risoluzione, durante l'imaging la proteina citoplasmatica ha mostrato che anche gli LBT potrebbero essere visualizzati all'interno della cellula.
"Ad alte concentrazioni, i lantanidi sono tossici per le cellule, "Vittore ha detto, "quindi era importante per noi dimostrare che potevamo trattare le cellule con una concentrazione di lantanidi molto bassa che fosse non tossica e abbastanza sostanziale da superare la membrana cellulare e visualizzare le proteine che volevamo vedere".
Ora, con questa nuova tecnica dimostrata con successo, gli scienziati sperano di poter utilizzare gli LBT per visualizzare altre proteine all'interno della cellula con una risoluzione di 10 nanometri.