Illustrazione. D'argento. Credito:@tsarcyanide/MIPT
I ricercatori dell'Istituto di fisica e tecnologia di Mosca hanno collaborato con colleghi in Russia e Arabia Saudita e hanno proposto un metodo efficiente per ottenere i dati fondamentali necessari per comprendere i processi chimici e fisici che coinvolgono sostanze allo stato gassoso. Il protocollo numerico proposto prevede l'effetto termico della formazione in fase gassosa dei composti d'argento e la loro entropia assoluta. Ciò include i primi dati in assoluto per oltre 90 composti. Pubblicato sulla rivista Chimica inorganica , i risultati sono importanti per applicazioni pratiche di sostanze contenenti argento, anche nella disinfezione dell'acqua e delle ferite, fotografia e cloud seeding.
Il team ha ricavato i valori precisi dell'entalpia di formazione e dell'entropia di numerosi composti d'argento. L'entalpia (dal greco "thalpein, " che significa "riscaldare") di un sistema descrive il suo stato in termini di energia delle particelle costituenti, pressione e volume. Secondo la legge di Hess, moltiplicando i coefficienti stechiometrici e la differenza tra le entalpie di formazione dei reagenti e quelle dei prodotti si ottiene la quantità di calore generata o consumata in una reazione chimica. L'entropia è una misura di quanto sia disordinato un sistema. La seconda legge della termodinamica afferma che un sistema può adottare spontaneamente uno stato meno organizzato, quindi l'entropia aumenta con il tempo.
Conoscere i valori di entalpia ed entropia è fondamentale per prevedere se una reazione si verificherà mai in determinate condizioni. Queste caratteristiche indicano anche come la resa della reazione e la selettività - il rapporto tra i prodotti - varino con la temperatura e la pressione, consentendo l'ottimizzazione. I risultati consentono ai ricercatori di fare previsioni sui processi chimici che si verificano nella fase gassosa. I dati aiuteranno anche a gestire i processi coinvolti nella deposizione di film sottili e campioni puri dalla fase gassosa.
Esistono fondamentalmente due modi per determinare i cambiamenti di entalpia ed entropia:attraverso esperimenti complessi e costosi, o utilizzando i dati dei libri di riferimento e facendo un po' di aritmetica basata sulla legge di Hess.
"La scelta sembra essere ovvia, a maggior ragione considerando che non è possibile misurare sperimentalmente il calore di alcune reazioni, " ha detto Yury Minenkov, ricercatore senior presso il Laboratorio di Metodi di Supercalcolo in Fisica della Materia Condensata. "Per esempio, la combustione incompleta della grafite produce sempre sia monossido di carbonio che anidride carbonica. Quindi, anche misurando l'effetto termico della reazione, non siamo riusciti a determinare l'entalpia di formazione del monossido di carbonio.
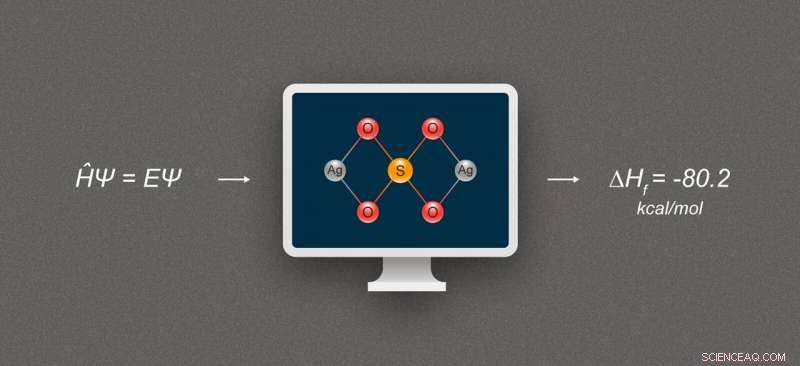
Figura 1. Diagramma semplificato che illustra il calcolo dell'entalpia di formazione per i composti dell'argento. Il composto raffigurato è solfato d'argento, Ag₂SO₄. Credito:@tsarcyanide/MIPT
"Ma l'approccio computazionale deve affrontare alcuni problemi, " continuò Minenkov. "Primo, le entalpie di formazione e le entropie non sono note per ogni composto. Secondo, anche se i dati sono disponibili, nessuno può garantire la loro accuratezza. I valori variano ampiamente tra i libri di riferimento. A volte, gli errori di misurazione possono essere piuttosto grandi."
Per fortuna, la chimica quantistica aiuta a ottenere l'entropia e, in una certa misura, i dati di entalpia. Ogni molecola costituente di una sostanza gassosa può essere vista come un sistema di nuclei caricati positivamente ed elettroni caricati negativamente. I ricercatori possono quindi applicare metodi di calcolo della struttura elettronica per risolvere l'equazione di Schrödinger molecolare. Questo rivela l'energia elettronica totale della molecola, la sua funzione d'onda, e la configurazione spaziale dei nuclei, cioè la sua struttura geometrica 3-D. I fisici possono quindi calcolare l'entropia e l'entalpia di un gas ideale composto da tali molecole. I valori di entropia così ottenuti vengono poi introdotti nei libri di riferimento e utilizzati nei calcoli termodinamici.
Il problema con l'entalpia è che, non essendo un valore fondamentale a questo punto, dipende significativamente dal metodo scelto per il calcolo dell'equazione di Schrödinger.
Le reazioni di atomizzazione vengono solitamente impiegate per calcolare l'entalpia di formazione. In tali reazioni, il composto di interesse si scompone in singoli atomi. Per esempio, solfuro d'argento—Ag 2 S:produce un atomo di zolfo e due d'argento. Poiché le entalpie di formazione delle sostanze atomiche sono ben note e riportate nei testi di riferimento, è possibile calcolare l'entalpia di formazione della sostanza iniziale, in questo caso, solfuro d'argento, trovando il cambiamento di entalpia nella reazione tramite metodi di chimica quantistica.
Però, quando le molecole composte da molti atomi subiscono l'atomizzazione, questo colpisce la struttura elettronica a tal punto che l'entalpia, pure, è notevolmente cambiato. I metodi attualmente disponibili della chimica teorica non possono spiegare questi effetti con sufficiente precisione.
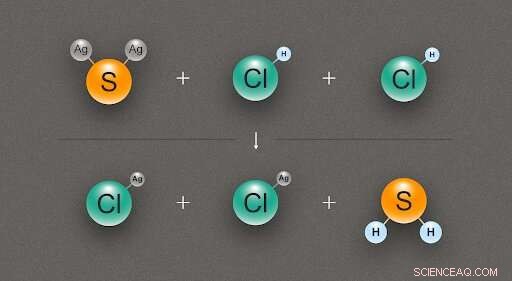
Figura 2. Un diagramma che illustra la reazione chimica tra un solfuro d'argento (Ag₂S) e due molecole di acido cloridrico (HCl), producendo due molecole di cloruro d'argento (AgCl) e una di idrogeno solforato (H₂S). Credito:@tsarcyanide/MIPT
Il team di ricercatori del MIPT, l'Istituto Frumkin di Chimica Fisica ed Elettrochimica dell'Accademia Russa delle Scienze, Ivanovo State University of Chemistry and Technology, e la King Abdullah University of Science and Technology dell'Arabia Saudita ha pubblicato una serie di articoli che propongono un modo per calcolare con maggiore precisione le caratteristiche termodinamiche dei composti organici e inorganici.
Nel caso del solfuro d'argento, i ricercatori hanno scoperto la sua entalpia di formazione dalla reazione con acido cloridrico, che produce cloruro d'argento e acido solfidrico (fig. 2). Poiché il numero di obbligazioni nella riga superiore è lo stesso della riga inferiore, la variazione di energia può essere calcolata con il minimo errore.
Il calore di formazione del cloruro d'argento, idrogeno solforato, e acido cloridrico sono noti con elevata precisione, e la modellazione al computer rivela l'effetto termico della reazione. Da questi dati, è possibile ricavare il calore di formazione del solfuro d'argento utilizzando la legge di Hess.
"Il classico approccio a cluster accoppiati, noto come CCSD(T), è il gold standard per risolvere l'equazione elettronica di Schrödinger nella moderna chimica quantistica, " ha spiegato Minenkov. "L'abbiamo sostituito con la versione locale chiamata DLPNO-CCSD(T), che è stato sviluppato non molto tempo fa al Max Planck Institute. Questo ha ridotto la potenza di calcolo richiesta di un ordine di grandezza. Sotto il convenzionale CCSD(T), il tempo di calcolo varia con la dimensione N della molecola come N 7 , quindi non è un'opzione per le grandi molecole. La versione locale richiede molto meno tempo e risorse."
Il team ha iniziato verificando quanto i risultati dei loro calcoli di chimica quantistica concordassero con i dati termodinamici e strutturali sperimentali. I libri di riferimento riportavano i valori per 10 composti d'argento, ed erano una buona partita. Avendo così assicurato che il loro modello sia adeguato, i ricercatori hanno calcolato le caratteristiche termodinamiche per 90 composti d'argento mancanti nei libri. I dati sono utili sia agli scienziati che lavorano nel campo della chimica dell'argento sia per testare e calibrare nuovi metodi di calcolo della struttura elettronica.