
Il dottor Ohkanda tiene il composto strategicamente progettato per agganciarsi al foro dell'enzima. Credito:Junko Ohkanda Ph.D., Professore di Assemblea accademica, Istituto di Agricoltura, Università di Shinshu
"La strategia era progettare il farmaco in modo che fosse in grado di agganciarsi al foro della FTase e della GGTase I, altrimenti la superficie delle proteine è troppo grande e scivolosa, " La dottoressa Junko Ohkanda dell'Università di Shinshu spiega la sua strategia alla base del suo articolo scelto da Chimica:una rivista europea come "carta calda".
Le aziende farmaceutiche di tutto il mondo hanno cercato di inventare un farmaco efficace per colpire le proteine K-Ras negli ultimi 20-30 anni. Quando le proteine K-Ras mutano, fanno sì che l'interruttore multiplo rimanga perennemente acceso, diventando una forma aggressiva e incurabile di cancro. Nel 90-100% dei tumori polmonari e pancreatici difficili, Si dice che K-Ras abbia un ruolo. Si dice che il 30% di tutti i tumori abbia una qualche forma di mutazione Ras.
Gli scienziati hanno avuto problemi a progettare un farmaco per infiltrare K-Ras a causa della mancanza di tasche interattive. È stata ideata una nuova strategia per attaccare il FTase, un importante enzima nella modificazione lipidica di K-Ras. Senza FTase, il K-Ras mutato non sarebbe in grado di moltiplicarsi in modo incontrollabile. Gli scienziati hanno sviluppato un gran numero di inibitori della FTasi, ma ha trovato difficile disattivare la modifica K-Ras.
Anche quando la FTase è stata inibita, Le modifiche al K-Ras non sono state interrotte perché anche GGTase I stava reagendo con il K-Ras, nonostante la sua diversa cavità reattiva. Non si capiva perché, fino a quando il suo meccanismo non è stato chiarito che FTase e GGTase I sono entrambi costituiti da due parti proteiche, uno dei quali è lo stesso, con lo stesso identico DNA.
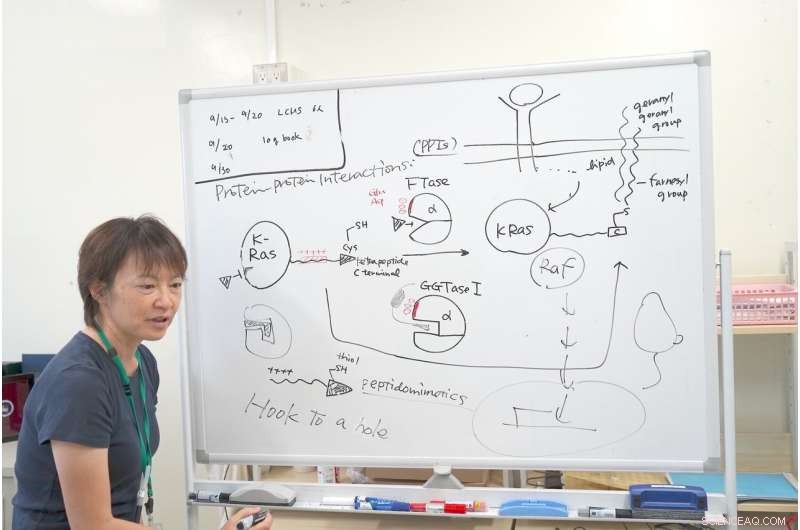
La dottoressa Ohkanda spiega il meccanismo della sua ricerca con K-Ras. Credito:Junko Ohkanda Ph.D., Professore di Assemblea accademica, Istituto di Agricoltura, Università di Shinshu
Vicino alla cavità attivata FTase e GGTase I hanno lo stesso cluster di amminoacidi acidi, come l'acido glutammico e l'acido aspartico, portando una carica negativa. Osservando da vicino il K-Ras C-terminale, aveva una carica positiva interattiva. Altre proteine Ras non hanno questa area carica positivamente. Solo K-Ras ha questo gruppo di cariche positive. Ecco perché anche se la FTase è stata inibita, il K-Ras reagiva ancora con la GGTase I, anche se la sua cavità era diversa.
È qui che la dottoressa Ohkanda ha avuto il suo momento di ispirazione. In teoria, la tasca dell'enzima e la chiave della cistina si attaccano e si uniscono. Ma in questo caso le superfici delle proteine, anche con il più e il meno interagiscono. Anche se la FTase è inibita, il K-Ras ha interagito erroneamente con la GGTase I. La dottoressa Ohkanda ei suoi colleghi pensavano che con un composto avrebbero potuto svolgere due funzioni.
La strategia è stata quella di progettare una molecola per imitare la parte del K-Ras che agisce sulla tasca attiva e anche sulla superficie acida. Va da sé che la funzione del farmaco deve avvenire all'interno della cellula. Le grandi molecole che sono utili nelle interazioni proteina-proteina sono spesso troppo grandi per entrare nella cellula. Questo è un problema che sconcerta molti sviluppatori di farmaci:i metodi di somministrazione.
La dottoressa Ohkanda ha pensato che se potesse progettare razionalmente il tiolo all'estremità del K-Ras per agganciarlo alla tasca attiva di FTase e GGTase I, la porzione di carica positiva interattiva estesa potrebbe interagire e penetrare nella membrana cellulare. Se la porzione di cisteina potesse agganciarsi nella cavità, la catena positiva interattiva connessa può essere piccola e consegnata strategicamente alla superficie acida degli enzimi. Era difficile ridurre al minimo le dimensioni del composto aumentandone la stabilità e mantenendo la sua capacità di reazioni chimiche. Utilizzando un peptidomimetico della stessa lunghezza e della stessa chiave, sono stati in grado di penetrare con successo nella cellula in vitro, interrompendo la moltiplicazione K-Ras in fuga.
Sono necessari ulteriori studi per aumentare l'attività del composto, test in vivo e per valutarne la tossicità molto prima che il composto possa essere utilizzato come trattamento per i tumori. Il Dr. Ohkanda continua a lavorare con un team internazionale di esperti per chiarire il meccanismo d'azione e le loro interazioni per progettare razionalmente farmaci efficaci per fermare la moltiplicazione di tali cellule.