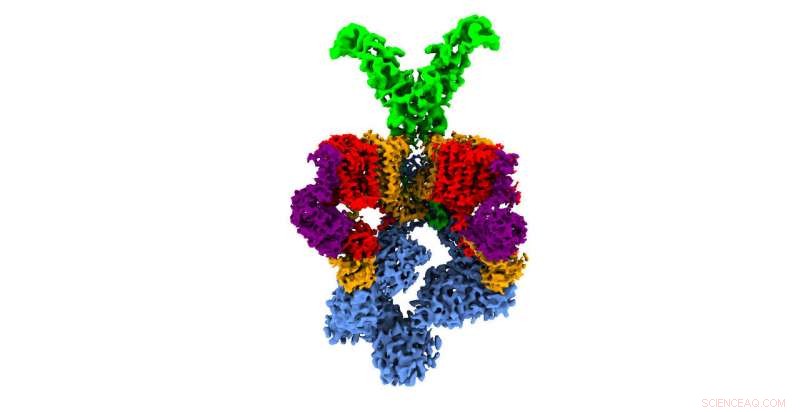
Struttura 3D del sistema di secrezione T7SS del batterio 'Mycobacterium smegmatis', simile a quello utilizzato dal batterio della tubercolosi durante l'infezione. Le diverse proteine che compongono questa nanomacchina sono mostrate in diversi colori. In blu, gli elementi del sistema situati all'interno del batterio sono responsabili di intrappolare i fattori di virulenza prodotti dal batterio e fornire l'energia necessaria per la loro secrezione. Nel verde, parte del sistema situata all'esterno della membrana del batterio, e ciò costituisce parte del poro da cui vengono secreti i fattori di virulenza. Attestazione:CNIO
Un team internazionale guidato da Óscar Llorca presso il Centro nazionale spagnolo di ricerca sul cancro (CNIO), e il gruppo guidato da Sebastian Geibel presso l'Università di Würzburg (Germania), riportare un accurato modello 3D del meccanismo utilizzato dal batterio Mycobacterium tuberculosis per bloccare la risposta immunitaria quando si infetta un organismo.
Questa scoperta tanto attesa è pubblicata in Natura . In un momento in cui i batteri stanno sviluppando sempre più resistenza agli antibiotici, porre fine all'epidemia di tubercolosi è uno dei problemi sanitari più urgenti degli Obiettivi di sviluppo sostenibile stabiliti dall'Organizzazione delle Nazioni Unite (ONU) per l'anno 2030.
La tubercolosi è una malattia infettiva con un alto tasso di mortalità:è una delle prime 10 cause di morte nel mondo, e colpisce soprattutto le persone con AIDS e altre immunodeficienze. Secondo i dati dell'OMS, 10 milioni di persone hanno contratto la tubercolosi nel 2017 in tutto il mondo, e 1,6 milioni sono morti. Poiché l'attuale trattamento è in uso da 40 anni e stanno emergendo nuovi ceppi della malattia resistenti agli antibiotici, la necessità di nuove strategie terapeutiche è urgente.
Batteri contro il sistema immunitario
Quando un organismo è infettato da M. tuberculosis, il sistema immunitario lancia una risposta complessa per distruggerlo. Il batterio ha evoluto diversi meccanismi sofisticati per minare il sistema immunitario. Il batterio utilizza un sistema di secrezione, un complesso proteico situato nella sua membrana, per iniettare determinati fattori di virulenza nelle cellule del sistema immunitario. Questi fattori sono molecole che paralizzano la risposta difensiva delle cellule immunitarie in modo che i batteri abbiano carta bianca per continuare a infettare il corpo.
La struttura e il meccanismo di funzionamento del sistema di secrezione di M. tuberculosis, chiamato T7SS (sistema di secrezione di tipo VII), non era stata studiata in dettaglio. Fino ad ora, erano state ottenute solo informazioni strutturali a bassissima risoluzione, che mostrava una struttura a forma di esamero (stella a sei punte) il cui centro funge da canale attraverso il quale il batterio espelle i fattori di virulenza. La mancanza di informazioni su T7SS e su come funziona a livello atomico ha impedito progressi nella realizzazione di nuove strategie terapeutiche contro la tubercolosi basate sull'attacco al sistema di secrezione.
Ora, i ricercatori Óscar Llorca e Ángel Rivera-Calzada del CNIO, che hanno contribuito con la loro esperienza nella microscopia crioelettronica (crio-EM) e nell'elaborazione di immagini digitali, e Sebastian Geibel e Nikolaos Famelis dell'Università di Würzburg, esperti in sistemi di secrezione batterica, forze combinate per svelare questo puzzle. Ora hanno descritto T7SS a livello atomico. I ricercatori hanno lavorato con un batterio molto simile, M. smegmatis, che viene utilizzato nella ricerca come modello per studiare M. tuberculosis e che condivide con esso lo stesso sistema di secrezione. Il lavoro ha dimostrato che T7SS è una sofisticata nanomacchina in cui diverse proteine cooperano per iniettare i fattori di virulenza prodotti dal batterio nelle cellule del sistema immunitario.
Verso una nuova generazione di farmaci
I recenti sviluppi hanno trasformato la crio-EM in una tecnologia estremamente potente che consente l'imaging ad alta risoluzione delle strutture molecolari. Questa tecnica accelera l'ottenimento di informazioni strutturali che altrimenti richiederebbero grandi volumi del campione o la sua cristallizzazione. Con questa tecnica, la biologia molecolare e la biomedicina stanno compiendo un enorme salto di qualità che dovrebbe rivoluzionare lo sviluppo dei trattamenti delle malattie.
In questo documento, i ricercatori hanno individuato tutti i componenti di T7SS, e ha chiarito la funzione di alcuni di essi che sono rimasti sconosciuti. Hanno anche modellato la sua struttura tridimensionale e proposto un meccanismo di funzionamento.
"Siamo stati in grado di vedere che i componenti che fino ad ora apparivano sfocati con altre tecniche sono, infatti, elementi in continuo movimento, " spiega Llorca. "Così, abbiamo visto che l'esamero di T7SS è composto da un sottocomplesso di 4 proteine e che sono necessarie 6 copie identiche di questo sottocomplesso per modellare la stella a sei punte attorno ad un poro centrale, attraverso i quali vengono espulsi i fattori di virulenza che bloccano la risposta difensiva dell'organismo infetto." Successivamente, il meccanismo proposto è stato testato dal gruppo dell'Università di Würzburg utilizzando versioni mutate del sistema.
Il sistema utilizzato dal gruppo tedesco per testare il meccanismo è di grande interesse anche per la comunità della ricerca. "Sarà molto utile testare l'effetto di nuove molecole dirette contro questo meccanismo di secrezione, di cui hanno bisogno i batteri del genere Mycobacterium per portare a termine con successo l'infezione, " spiega Rivera-Calzada.
Questo studio multidisciplinare apre un nuovo campo da esplorare per le malattie causate da infezioni batteriche, poiché conoscere le strutture tridimensionali dei sistemi di secrezione batterica consentirà di esplorare nuovi composti che bloccano la secrezione. Nelle fasi successive di questa ricerca, il team del CNIO e dell'Università di Würzburg cercherà di studiare in modo più approfondito come avviene il processo di secrezione in Mycobacterium per aprire la strada alla progettazione di molecole in grado di bloccarlo.