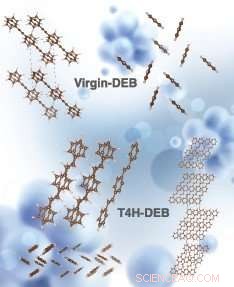
Strutture cristalline simulate di virgin-DEB e T4H-DEB (chimicamente note come 1, 4-distirilbenzene, un trans-isomero del prodotto intermedio DEB dopo la cattura dei primi 4 atomi di idrogeno con 2 legami CH sui lati opposti della catena di carbonio). Le strutture in alto a sinistra e in alto a destra corrispondono alla vista laterale e alla vista dall'alto del DEB vergine, rispettivamente. Il centro a destra, le strutture in basso a destra e in basso a sinistra corrispondono alla vista laterale, vista dall'alto e una cella unitaria (vista laterale) di T4H-DEB, rispettivamente. Credito:la simulazione è stata eseguita da Hom Sharma. La resa artistica dell'immagine è stata eseguita da Alexandria Holmberg Diaz, Laboratorio Nazionale Lawrence Livermore.
L'eccesso di idrogeno può causare problemi in una varietà di settori. Può corrodere i semiconduttori, elettronica, e combustibile nucleare in deposito. Rappresenta anche un rischio di esplosione. Per rimuovere questo idrogeno in più, i chimici possono usare un composto organico chiamato getter di idrogeno che si lega chimicamente a diversi atomi di idrogeno.
Ma a volte, durante questo processo di legame, chiamato idrogenazione catalitica, i prodotti parzialmente idrogenati diventano volatili, fondendosi ed evaporando prima che possano legarsi a più atomi di idrogeno. Ora, i ricercatori hanno esplorato come e perché questa volatilità varia durante l'idrogenazione, suggerendo che il principale colpevole è un effetto precedentemente sottovalutato dei legami carbonio-idrogeno nella molecola.
La nuova analisi, pubblicato su The Giornale di Fisica Chimica , può aiutare i chimici a identificare le condizioni ideali necessarie per l'idrogenazione catalitica in modo da poter rimuovere meglio l'idrogeno in eccesso.
"Questo crea un modello per il comportamento di altri getter organici, permettendoci di prevedere le loro temperature e ambienti operativi ottimali, " disse Long Dinh, un fisico al Lawrence Livermore National Laboratory.
Dinh e i suoi colleghi si sono concentrati su un getter chiamato 1, 4 bis(feniletinil)benzene, o DEB. Per rimuovere l'idrogeno, i fiocchi di cristallo di DEB vengono miscelati con catalizzatori sotto forma di pellet solidi. I pellet sono realizzati con carbone attivo, la cui struttura porosa fornisce un'abbondante superficie, rivestiti con nanoparticelle di palladio. Il catalizzatore al palladio divide le molecole di idrogeno in atomi di idrogeno, che può quindi legarsi a DEB e formare legami carbonio-idrogeno.
DEB è un getter ad alta capacità, capace di legarsi con un massimo di otto atomi di idrogeno. La maggior parte dei ricercatori pensava che quando i getter come il DEB si legano a più atomi di idrogeno e si ingrandiscono, diventano più volatili. Ad alte temperature di esercizio, possono quindi vaporizzare via, alla deriva lontano dai pellet catalitici dove non ci sono atomi di idrogeno con cui legarsi. "Si interrompe prematuramente il processo di idrogenazione, "Din ha detto.
Ma i ricercatori hanno scoperto che nelle prime due fasi dell'idrogenazione, quando DEB forma due legami carbonio-idrogeno per fase (i legami carbonio-idrogeno vengono creati sui lati opposti della catena di carbonio della molecola), la molecola effettivamente diminuisce di volatilità. Solo nelle successive fasi di idrogenazione il DEB diventa più volatile.
Per studiare come e perché DEB cambia nella volatilità, i ricercatori hanno misurato proprietà come pressioni di vapore e punti di fusione, struttura molecolare sondata, e ha eseguito simulazioni computerizzate di meccanica quantistica per modellare il processo di idrogenazione. La loro analisi suggerisce che i legami carbonio-idrogeno nel DEB svolgono un ruolo chiave nel comportamento volatile della molecola.
Durante l'idrogenazione, l'idrogeno si lega agli atomi di carbonio nel DEB. Secondo il pensiero convenzionale, il legame carbonio-idrogeno risultante è non polare:nessuna delle estremità della struttura del bilanciere è caricata più negativamente o positivamente dell'altra. Ma si scopre che l'estremità del carbonio è leggermente più negativa, e il legame carbonio-idrogeno forma un dipolo debole, Din ha spiegato.
Come dipolo, un legame carbonio-idrogeno può attrarre o respingere altri legami carbonio-idrogeno in altre molecole DEB. A seconda di come sono disposti i legami carbonio-idrogeno e di quanti ce ne sono nei prodotti DEB intermedi, le molecole possono attrarsi o respingersi a vicenda, e quindi essere meno o più volatile, rispettivamente. La ricerca precedente aveva trascurato queste interazioni collettive tra i legami carbonio-idrogeno nei cristalli organici, Din ha detto.
Dalla loro analisi, i ricercatori hanno determinato che le condizioni ottimali per l'idrogenazione del DEB sono inferiori a circa 175 gradi Fahrenheit, se fatto in un buon vuoto. "I nostri risultati, "Din ha detto, "può essere applicato in modo analogo anche ad altri sistemi getter di idrogeno organico catalitico".