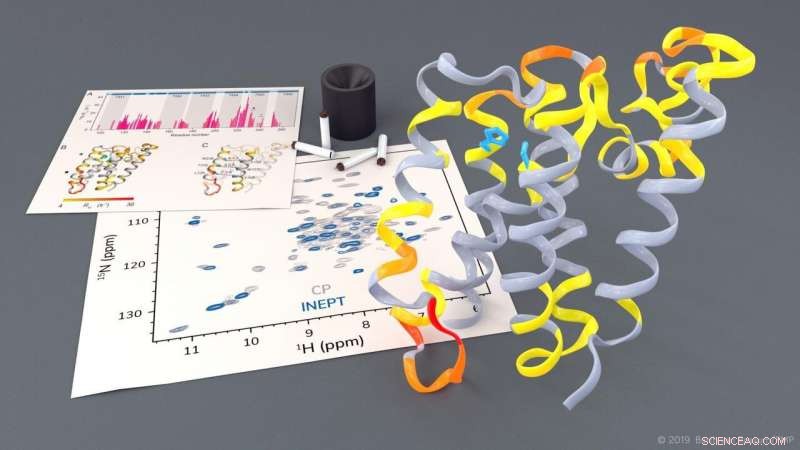
Indagine sulla proteasi romboidale GlpG mediante NMR allo stato solido. Credito:Barth van Rossum, FMP
Le proteasi romboidi sono proteine di membrana clinicamente rilevanti che svolgono un ruolo chiave in varie malattie. Utilizzando la spettroscopia NMR allo stato solido, i ricercatori del Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) di Berlino sono ora in grado di osservare le proteasi romboidali al lavoro in un ambiente lipidico nativo. Le immagini dinamiche ottenute saranno utili per lo sviluppo di nuovi farmaci per malattie come il Parkinson e la malaria. I risultati di questo lavoro pionieristico sono stati appena pubblicati nel Giornale della Società Chimica Americana .
Decine di migliaia di proteine sono al lavoro nelle nostre cellule, intorno all'orologio. Alcuni di questi industriosi lavoratori siedono nella membrana cellulare, tra questi la famiglia delle proteasi romboidali. Dato che queste proteasi intramembrana sono coinvolte in molti processi biologici, e svolgono anche un ruolo chiave in malattie come il Parkinson, diabete, cancro e malaria, sono altamente clinicamente rilevanti.
In precedenza, era stato possibile visualizzare le proteasi romboidali utilizzando la cristallografia a raggi X. Però, questo metodo era solo in grado di fornire immagini statiche da proteine in un ambiente artificiale. Pertanto è rimasto di grande interesse vedere cosa succede nella membrana cellulare dove le proteine svolgono il loro compito principale, che sta scindendo altre proteine di membrana, innescando una cascata di segnalazioni.
Il cancello a lungo sospettato che si apre in effetti esiste
Il gruppo di ricerca guidato dal professor Adam Lange del Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) è stato ora in grado di studiare questo processo altamente complesso, per la prima volta utilizzando la spettroscopia NMR allo stato solido in un ambiente simile a quello nativo. I ricercatori sono stati in grado di osservare come si muovono alcune parti della proteasi. Hanno anche notato che, per scindere altre proteine, un cancello si apre brevemente per consentire a queste proteine substrato di entrare nel centro attivo della proteasi.
Risultati rilevanti per l'interferenza farmacologica
Il progetto, intraprese nell'ambito del Cluster di Eccellenza UniSysCat, pone le basi per una caratterizzazione ancora migliore delle proteasi romboidali. Inoltre:le conoscenze acquisite saranno utili ai ricercatori per studiare come possono influenzare farmacologicamente le proteine di membrana clinicamente rilevanti. Anche Lange e il suo team ora vogliono cercare sostanze per inibire le proteasi romboidali erranti.