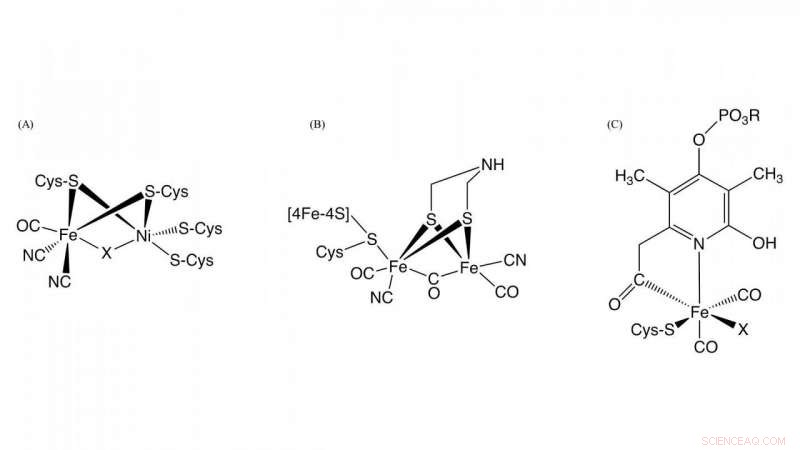
Figura 1. Struttura dei siti attivi in [NiFe]-idrogenasi, [FeFe]-idrogenasi, e [Fe]-idrogenasi Credito:NINS/IMS
Un gruppo di ricerca che comprende ricercatori dell'Exploratory Research Center on Life and Living Systems (ExCELLS), Institute for Molecular Science (IMS) negli Istituti Nazionali di Scienze Naturali, e l'Università di Osaka hanno rivelato il meccanismo dettagliato della biosintesi del monossido di carbonio essenziale per la maturazione del sito attivo della NiFe-idrogenasi.
idrogenasi, che è un metalloenzima responsabile dell'ossidazione dell'idrogeno gassoso e della riduzione dei protoni, svolge un ruolo chiave nel metabolismo dell'idrogeno batterico. Sulla base delle differenze di contenuto di metallo nel sito attivo, sono classificati in tre gruppi:NiFe-, FeFe-, e Fe-idrogenasi contenenti diversi complessi metallici come centri attivi in questi enzimi (Figura 1). Sebbene le strutture nei loro centri attivi siano diverse, è essenziale per l'attività dell'idrogenasi che il monossido di carbonio (CO) sia coordinato allo ione ferro nel centro attivo. È noto che la CO viene biosintetizzata da una reazione enzimatica, ma il dettaglio della biosintesi di CO era sconosciuto.
In questa ricerca, il gruppo ha determinato la struttura cristallina dell'enzima (HypX) responsabile della biosintesi di CO (Figura 2), in base al quale HypX biosintetizza CO mediante una reazione senza precedenti per la maturazione della NiFe-idrogenasi. HypX è costituito da due domini:i domini N-terminale e C-terminale. All'interno di HypX è presente una cavità continua che collega i domini N- e C-terminali (Figura 2). Nella struttura cristallina, il coenzima A (CoA) è legato alla regione C-terminale della cavità.
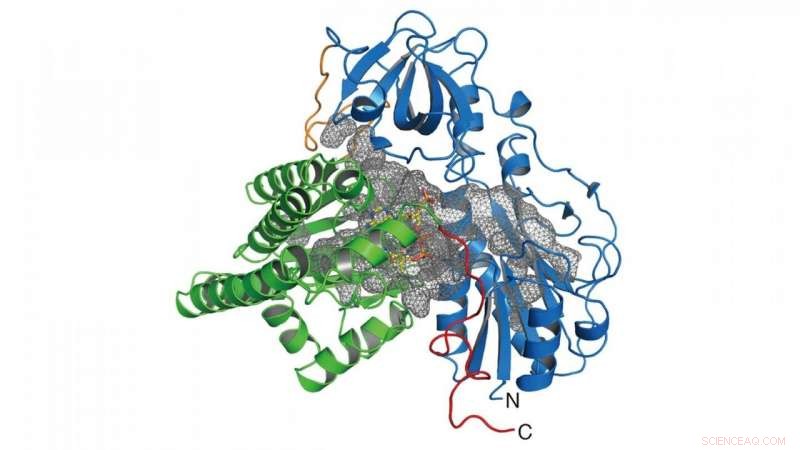
Figura 2. Struttura cristallina di HypX. I domini N- e C-terminali sono mostrati in blu e verde, rispettivamente. La cavità all'interno di HypX è mostrata in una maglia grigia. Credito:NINS/IMS
Due diverse reazioni si verificano nei domini N- e C-terminali. Nel dominio N-terminale, una reazione di trasferimento del gruppo formil dal formiltetraidrofolato, che è legato nella regione N-terminale della cavità come substrato di CoA, avviene (fase di reazione 1 in Fig. 3). A quest'ora, Il CoA nella cavità adotta la conformazione lineare estesa, e il gruppo SH di CoA si trova vicino al gruppo formile nel formiltetraidrofolato legato nel dominio N-terminale. Quindi, il formil-CoA viene prodotto come intermedio di reazione dalla reazione di trasferimento del gruppo formil dal formiltetraidrofolato al CoA.
Nel passaggio successivo, il formil-CoA subisce un grande cambiamento conformazionale nella cavità in modo che il gruppo formile nella posizione terminale del formil-CoA si trovi nel sito attivo nel dominio C-terminale di HypX (fase di reazione 2 in Fig. 3). Nel dominio C-terminale, La CO è formata dalla decarbonilazione del formil-CoA (fase di reazione 3 in Fig. 3).
Questa reazione di biosintesi della CO è una reazione nuova e senza precedenti. Il CoA è noto come coenzima, che ha un ruolo importante nel metabolismo degli acidi grassi e nel metabolismo energetico cellulare attraverso il ciclo dell'acido citrico. Però, non è mai stato riportato che CoA/formil-CoA sia coinvolto nelle reazioni di biosintesi della CO. Questa ricerca ha rivelato una nuova funzione fisiologica di un noto coenzima CoA.
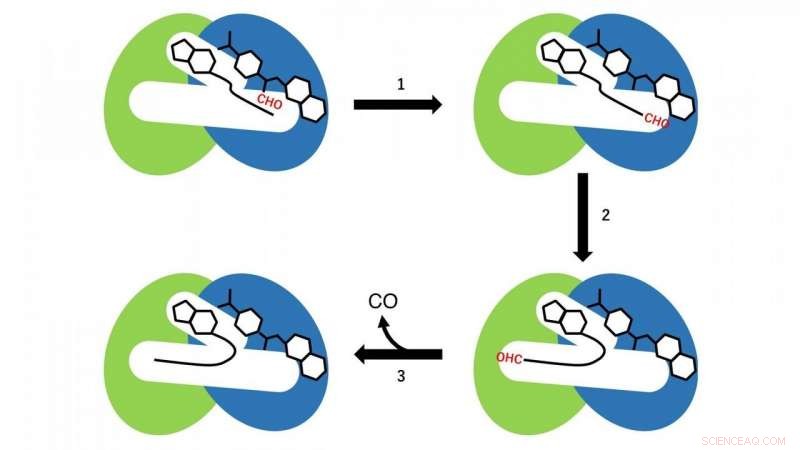
Figura 3. Schema di reazione della biosintesi di CO di HypX. I domini N- e C-terminali sono mostrati rispettivamente in blu e verde. Il gruppo formile (CHO) è mostrato in rosso. Credito:NINS/IMS
Prospettive future:
I meccanismi biosintetici dei metalloenzimi rimangono in molti casi sconosciuti. Resta da chiarire soprattutto come sono stati assemblati i centri attivi contenenti metallo dei metalloenzimi. In questo lavoro, abbiamo determinato la prima struttura cristallina dell'enzima che catalizza la reazione biosintetica del monossido di carbonio essenziale per la costruzione del sito attivo della [NiFe] idrogenasi. Nel futuro, continueremo la ricerca per chiarire il meccanismo dettagliato dell'intera via di maturazione dell'idrogenasi basata su questo risultato.