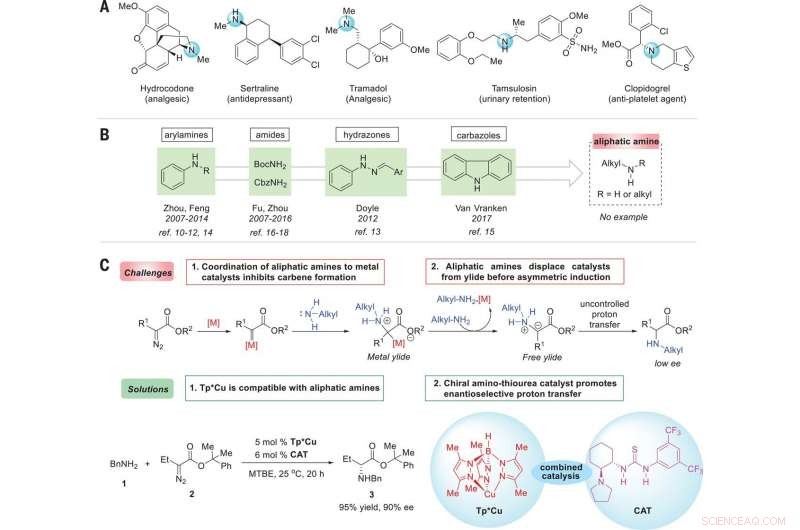
Strategia per l'enantiocontrollo delle reazioni di inserzione N–H di ammine alifatiche con carbeni. (A) Farmaci rappresentativi che dimostrano l'ubiquità delle ammine alifatiche chirali nelle molecole bioattive. (B) Fonti di ammine segnalate per reazioni di inserimento N–H enantioselettive. (C) Reazioni di inserzione N–H catalizzate da metalli di transizione enantioselettivi con ammine alifatiche:sfide e soluzioni. Condizioni di reazione ottimali:La reazione di 1 (0,2 mmol), 2 (0,22 mmol), Tp*Cu (5 moli %), e CAT (6 moli %) è stata effettuata in 3 ml di metil tert-butil etere (MTBE) a 25°C per 20 ore. BnNH2, benzilammina; BocNH2, tert-butil carbammato; CbzNH2, carbammato di benzile; Me, metile; Et, etilico; Ph, fenile; M, metallo; rif., riferimento. Credito: Scienza (2019). doi:10.1126/science.aaw9939
Un team di chimici della Nankai University ha sviluppato un approccio in due fasi per convertire le ammine alifatiche in amminoacidi non naturali. Nel loro articolo pubblicato sulla rivista Scienza , il gruppo descrive il loro approccio, come funzionava bene, e applicazioni che potrebbero trarre vantaggio dal suo utilizzo. John Ovian ed Eric Jacobsen dell'Università di Harvard hanno pubblicato un articolo complementare nello stesso numero della rivista che delinea alcuni degli ostacoli alla creazione di legami con ricchi reagenti azotati; descrive anche l'approccio utilizzato dal team in Cina.
I ricercatori hanno iniziato osservando che le ammine chirali sono utilizzate in un'ampia varietà di prodotti naturali, e sottolineare che sono altrettanto ampiamente utilizzati nei prodotti agrochimici e farmaceutici. Notano che il 43% dei 200 farmaci da prescrizione più prescritti nel 2016 aveva almeno una frazione di ammina analifatica. Notano inoltre che a causa di ciò, lo sviluppo di reazioni catalizzate da metalli di transizione enantioselettivi che formano legami C–N sono di grande interesse nei circoli della chimica.
Come notano Ovian e Jacobsen, i chimici usano una varietà di composti che hanno legami carbonio-azoto in uno dei due possibili orientamenti dell'immagine speculare. Ma come sottolineano anche ciò può presentare difficoltà a causa dell'interazione dell'azoto con un determinato catalizzatore. In questo nuovo sforzo, i ricercatori hanno trovato un modo per aggirare questo problema sviluppando un approccio in due fasi per convertire le ammine alifatiche in amminoacidi non naturali. Nel loro approccio, hanno applicato un catalizzatore di rame come mezzo per attivare un reagente di carbonio, quindi hanno aggiunto un catalizzatore di tiourea che era un legame idrogeno per produrre prodotti ad alta selettività. Notano che il successo della trasformazione dipendeva dalle proprietà uniche di entrambi i catalizzatori. Riferiscono inoltre che la reazione risultante dovrebbe funzionare ugualmente bene con un'ampia gamma di derivati diazo di un partner di accoppiamento estere/ammina.
Ovian e Jacobsen notano inoltre che l'associazione di un'ammina con un carbenoide ha consentito la stabilizzazione da parte di un gruppo carbossilico e ha fornito un buon modo per creare derivati innaturali di α-amminoacidi. Il metodo traccia anche un percorso per estendere le inserzioni di carbenoidi catalizzate da metallo nei legami N-H alle ammine alifatiche e rappresenta il potenziale per lo sviluppo di nuove trasformazioni asimmetriche.
© 2019 Scienza X Rete