La trietanolammina (TEOA) è attivamente impegnata nelle fasi chiave della reazione del ciclo fotocatalitico per la conversione dell'anidride carbonica (CO2) da parte dei complessi di rutenio carbonile. Credito: Giornale della Società Chimica Americana
Le piante assorbono energia dalla luce solare per trasformare l'anidride carbonica atmosferica (CO2) in zuccheri e quindi in altri materiali per la crescita e le funzioni metaboliche. Imitare questa reazione fotochimica per convertire in modo efficiente la CO2 in combustibili e sostanze chimiche importanti a livello industriale sosterrebbe un futuro energetico sostenibile e ridurrebbe le emissioni di gas serra.
Per realizzare tale fotosintesi artificiale, gli scienziati hanno studiato sistemi catalitici composti da più componenti che lavorano insieme per guidare il trasferimento di elettroni fotoindotti necessari per convertire la CO2 in prodotti ricchi di energia. Uno di questi prodotti è il formiato, una forma salina di acido formico, una sostanza chimica organica presente in natura composta da molecole di idrogeno e CO2. La produzione di formiato da CO2 è considerata una strategia interessante per lo stoccaggio a lungo termine dell'energia solare rinnovabile in forma chimica.
I sistemi di conversione della CO2 multicomponente includono tipicamente un fotosensibilizzatore, un catalizzatore, e un donatore di elettroni sacrificale in soluzione. Dopo aver assorbito la luce, il fotosensibilizzatore passa a uno stato eccitato, dove accetta elettroni dal donatore. Il catalizzatore, la cui funzione è ridurre al minimo la barriera ad alta energia per attivare la CO2, una molecola molto stabile, quindi utilizza questi elettroni ad alta energia per completare una serie di reazioni.
Per molti studi sulla conversione fotochimica della CO2 utilizzando catalizzatori molecolari, come quelli a base di rutenio e altri complessi metallici, la trietanolammina (TEOA) è il componente che dona gli elettroni. O, in alcuni casi, TEOA accetta un protone (ione idrogeno caricato positivamente) da un donatore di elettroni più efficiente per garantire il suo comportamento sacrificale. Nonostante l'ampio uso di TEOA, gran parte della ricerca fino ad oggi non ha considerato la possibilità che questa componente svolga ruoli secondari, come cambiare le specie chimiche temporanee (intermedi) generate all'interno del ciclo catalitico o aumentare le velocità di reazione.
Un team di chimici del Brookhaven National Laboratory del Dipartimento dell'Energia degli Stati Uniti (DOE) e il Baruch College della City University di New York hanno deciso di cambiare le cose.
"Negli ultimi 40 anni, la maggior parte degli studi sui catalizzatori per la riduzione della CO2 si sono concentrati sull'analisi dell'efficienza catalitica e della selettività per il prodotto finale, " disse Renato Sampaio, un ricercatore associato nel gruppo di fotosintesi artificiale della divisione di chimica del Brookhaven Lab. "Però, è importante sapere se e come TEOA interagisce con il catalizzatore durante le fasi intermedie del ciclo catalitico perché queste interazioni possono influenzare in modo decisivo l'efficienza e la selettività della formazione del prodotto."
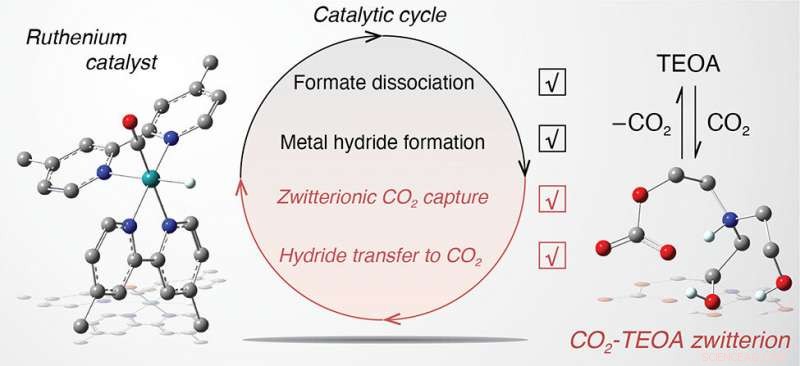
Concentrandosi su un noto sistema catalitico in una soluzione di acetonitrile costituito da un catalizzatore di rutenio carbonile (atomo di carbonio legato all'atomo di ossigeno), un fotosensibilizzatore a base di rutenio, un donatore di elettroni comune noto come BIH, e TEOA che agisce come accettore di protoni per promuovere il comportamento sacrificale della BIH, i chimici fecero alcune scoperte sorprendenti. Come riportato in un articolo pubblicato online il 27 dicembre su Giornale della Società Chimica Americana , TEOA fallisce nel suo compito principale di accettare in modo efficiente protoni dalla BIH, limitando così l'attività catalitica. Però, TEOA migliora le fasi chiave del ciclo catalitico per la conversione della CO2 in formiato, il prodotto di destinazione.

Nella divisione di chimica di Brookhaven Lab, (da destra) David Grills, Renato Sampaio, ed Etsuko Fujita discutono i risultati di un'indagine spettroelettrochimica su uno di una serie di catalizzatori carbonilici di rutenio mentre Dmitry Polyansky prepara una cella elettrochimica per il prossimo esperimento. Il gruppo, tra cui anche David Szalda del Baruch College (non nella foto), hanno scoperto che un componente ampiamente utilizzato nella riduzione fotochimica (indotta dalla luce) dell'anidride carbonica in prodotti utilizzabili ricchi di energia migliora le fasi chiave del ciclo catalitico. Credito:Brookhaven National Laboratory
Per esempio, Il TEOA agisce come una fonte di protoni supportando la formazione di un idruro metallico (rutenio attaccato all'idrogeno) che successivamente interagisce con la CO2 per formare formiato legato (legato al rutenio). Inoltre, TEOA interagisce con la CO2 per formare un "addotto zwitterionico, " una molecola contenente cariche elettriche sia positive che negative. Quando questo addotto è presente in soluzione, l'idruro metallico interagisce con la CO2 per produrre formiato legato a una velocità di sei ordini di grandezza più veloce di quella senza TEOA. La dissociazione del formiato legato in formiato "libero", che può essere catturato come prodotto finale, è anche sei ordini di grandezza più veloce a causa del TEOA.
Per fare queste determinazioni, il team ha raccolto dati sia elettrochimici che spettroscopici.
"Il ciclo catalitico può generare un gran numero di intermedi di reazione, " ha spiegato l'autore corrispondente Etsuko Fujita, capo del gruppo di fotosintesi artificiale. "La sfida è caratterizzarli con tecniche spettroscopiche o elettrochimiche".
Primo, il team ha misurato i potenziali di riduzione del catalizzatore (quanto facilmente il catalizzatore guadagna un elettrone) in presenza e assenza di TEOA. Quindi, hanno caratterizzato le vibrazioni spettroscopiche del carbonile per diverse forme del catalizzatore prima e dopo aver ricevuto un elettrone. A seguito di queste misurazioni elettrochimiche, hanno condotto esperimenti di spettroscopia infrarossa risolta nel tempo su scale temporali di nanosecondi per monitorare gli intermedi catalitici in un'atmosfera di CO2.
"Il carbonile legato al rutenio ci ha permesso di studiare ogni forma intermedia transitoria del catalizzatore, " ha spiegato Sampaio. "Il carbonile è un reporter spettroscopico infrarosso molto sensibile che rimane legato al rutenio durante tutto il ciclo catalitico, a differenza di altre parti del catalizzatore. La sua frequenza vibrazionale, o moto atomico, cambia drasticamente quando il catalizzatore accetta un elettrone o subisce altri cambiamenti strutturali. Possiamo rilevare questi cambiamenti e visualizzarli insieme alle misurazioni elettrochimiche per dire quali specie sono presenti".
Negli studi futuri, il team esplorerà alternative al TEOA che massimizzano la capacità sacrificale della BIH offrendo vantaggi simili nel miglioramento del ciclo catalitico.
"Anche se il nostro studio si è concentrato su una classe specifica di catalizzatori, crediamo fermamente che i nostri risultati siano ampiamente applicabili in altri sistemi e dovrebbero essere presi in considerazione quando si studia la riduzione catalitica della CO2 in formazione, " disse Fujita.