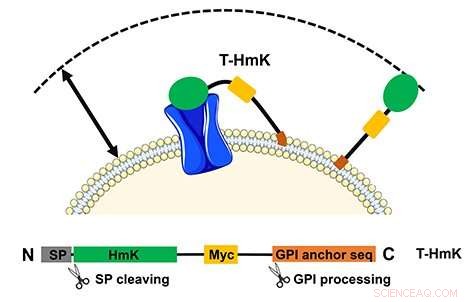
La tossina legata (T-HmK) viene liberata e legata a un canale del potassio (blu) espresso nella membrana cellulare. Il volume di reazione che un T-HmK può visitare (freccia a due punte) è determinato dalle lunghezze combinate del linker peptidico flessibile, l'ancora GPI, e il diametro della tossina HmK. Il pannello inferiore mostra il progetto del costrutto dell'espressione. Credito:UCI School of Medicine
Nel passato, peptidi biologicamente attivi - piccole proteine come neurotossine e ormoni che agiscono sui recettori cellulari per alterare la fisiologia - sono stati purificati da fonti native come i veleni e poi sono stati prodotti pannelli di varianti nei batteri, o sintetizzato, studiare le basi strutturali dell'interazione recettoriale. Una nuova tecnica chiamata scansione zombie rende obsoleti questi vecchi processi.
I peptidi sono usati per la terapia medica e per studiare la biologia, tra l'altro, ma il loro costo di produzione in tempo e denaro è sempre più elevato.
"Se un peptide ha 30 residui, semplicemente cambiare ogni sito una volta richiede la sintesi, purificazione e validazione della composizione ripiegata di tutte e 30 le varianti, un processo che richiede mesi e molte migliaia di dollari, " ha detto Steven A.N. Goldstein, dottore, dottorato di ricerca, vice rettore per gli affari sanitari presso l'Università della California, Irvine, e illustre professore nei dipartimenti di pediatria e fisiologia e biofisica della Scuola di Medicina dell'UCI.
Pubblicato oggi in Progressi scientifici , il nuovo studio co-guidato da Goldstein e Jordan H. Chill, dottorato di ricerca, un professore nel Dipartimento di Chimica dell'Università Bar-Ilan in Israele, rivela come i ricercatori sono stati in grado di dirottare il macchinario cellulare per semplificare la creazione di peptidi consentendo un'ampia, studi rapidi di struttura-funzione e meccanismo per migliorare la specificità e l'affinità di azione, i parametri importanti per l'efficacia terapeutica.
"Dal momento che dirottiamo il macchinario cellulare per sintetizzare e visualizzare i peptidi sulla superficie cellulare con il recettore, chiamiamo questa scansione zombie, " ha detto il primo autore Ruiming Zhao, dottorato di ricerca, un investigatore nel laboratorio Goldstein.
"Utilizzando questa nuova tecnica, i cambiamenti dei peptidi sono semplici come la sintesi del plasmide e richiedono solo giorni di lavoro e pochi centesimi per costrutto. Questo ci consente di studiare i ruoli di molti siti con molti cambiamenti in un periodo di tempo molto più breve a un costo molto inferiore".
Lo studio, intitolato, "Le neurotossine peptidiche legate mostrano due meccanismi di blocco nel poro del canale K+ così come i loro analoghi non legati, " delinea come i peptidi codificati sono collegati tramite un percorso nativo all'esterno della cellula su un cavo flessibile. In questo caso, anche il recettore bersaglio è stato espresso da un plasmide e potrebbe essere modificato. Il metodo consente anche lo studio di interazioni a bassa affinità che altrimenti non sarebbe possibile analizzare.
Usando la scansione degli zombi, i ricercatori hanno fatto l'inaspettata scoperta che un peptide negli studi clinici come immunosoppressore agisce in modo diverso da quanto si pensava una volta, rivelando che questa famiglia di neurotossine ha due possibili modalità di interazione con i canali del potassio piuttosto che una sola.
Chill e il collega Netanel Mendelman, dottorato di ricerca, ha potenziato l'impatto di questi risultati spiegando la struttura tridimensionale di una neurotossina selezionata utilizzando la risonanza magnetica nucleare (NMR).
"Stimando centinaia di distanze e angoli tra gli atomi nel peptide, ora conosciamo la sua struttura, offrendo un contesto molecolare per questi risultati entusiasmanti, " ha detto Chill. "Le due modalità di legame sembrano comportare un 'capovolgimento' della tossina o qualche riarrangiamento della sua struttura atomica."
Le modalità di legame alternative descritte per questi peptidi sono un fastidioso fattore di confusione nella progettazione di farmaci basati sulla struttura, evidenziando l'importanza dei risultati di questo rapporto e degli studi futuri sul processo di riconoscimento tra canali e peptidi inibitori.