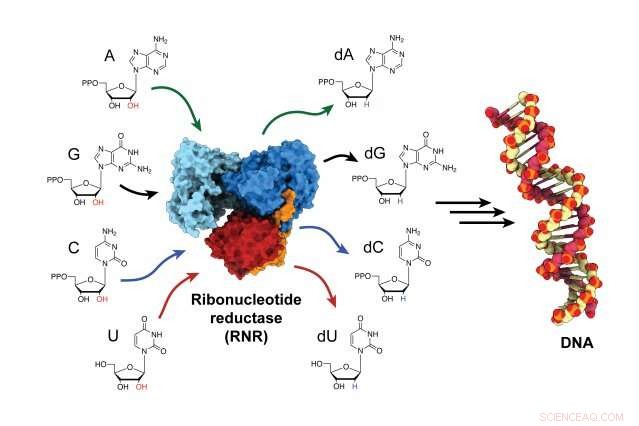
L'enzima ribonucleotide reduttasi (RNR) è responsabile della conversione dei mattoni dell'RNA in blocchi del DNA, ed è un attore fondamentale sia nella sintesi che nella riparazione del DNA in tutti gli organismi. Attestazione:Gyunghoon "Kenny" Kang
Come si cattura un processo cellulare che avviene in un batter d'occhio? I biochimici del MIT hanno escogitato un modo per intrappolare e visualizzare un enzima vitale nel momento in cui diventa attivo, informando lo sviluppo di farmaci e rivelando come i sistemi biologici immagazzinano e trasferiscono energia.
L'enzima, ribonucleotide reduttasi (RNR), è responsabile della conversione degli elementi costitutivi dell'RNA in elementi costitutivi del DNA, per costruire nuovi filamenti di DNA e riparare quelli vecchi. RNR è un bersaglio per le terapie antitumorali, così come i farmaci che curano le malattie virali come l'HIV/AIDS. Ma per decenni, gli scienziati hanno faticato a determinare come si attiva l'enzima perché avviene così rapidamente. Ora, per la prima volta, i ricercatori hanno intrappolato l'enzima nel suo stato attivo e hanno osservato come l'enzima cambia forma, avvicinando le sue due subunità e trasferendo l'energia necessaria per produrre i mattoni per l'assemblaggio del DNA.
Prima di questo studio, molti credevano che le due subunità di RNR si unissero e si adattassero con una perfetta simmetria, come una chiave in una serratura. "Da 30 anni, questo è quello che abbiamo pensato, "dice Catherine Drennan, un professore di chimica e biologia del MIT e un investigatore dell'Howard Hughes Medical Institute. "Ma ora, possiamo vedere che il movimento è molto più elegante. L'enzima sta effettivamente eseguendo una "danza quadrata molecolare", ' dove diverse parti della proteina si agganciano e oscillano attorno ad altre parti. È davvero molto bello".
Drennan e JoAnne Stubbe, professore emerito di chimica e biologia al MIT, sono gli autori senior dello studio, che è apparso sul giornale Scienza il 26 marzo. L'ex studente laureato Gyunghoon "Kenny" Kang Ph.D. '19 è l'autore principale.
Tutte le proteine, compreso RNR, sono composti da unità fondamentali note come amminoacidi. Da oltre un decennio, Il laboratorio di Stubbe ha sperimentato la sostituzione degli amminoacidi naturali di RNR con quelli sintetici. Così facendo, il laboratorio si è reso conto che potevano intrappolare l'enzima nel suo stato attivo e rallentarne il ritorno alla normalità. Però, solo quando il laboratorio Drennan ha avuto accesso a un progresso tecnologico chiave, la microscopia crioelettronica, è stato possibile scattare immagini ad alta risoluzione di questi enzimi "intrappolati" dal laboratorio Stubbe e dare un'occhiata più da vicino.
"Non avevamo davvero fatto alcuna microscopia crioelettronica al punto in cui abbiamo iniziato attivamente a provare a fare l'impossibile:ottenere la struttura di RNR nel suo stato attivo, "Drennan dice. "Non posso credere che abbia funzionato; Mi sto ancora pizzicando".
La combinazione di queste tecniche ha permesso al team di visualizzare la complessa danza molecolare che consente all'enzima di trasportare la "potenza di fuoco" catalitica da una subunità all'altra, per generare elementi costitutivi del DNA. Questa potenza di fuoco è derivata da un elettrone spaiato altamente reattivo (un radicale), che deve essere attentamente controllato per prevenire danni all'enzima.
Secondo Drennan, il team "voleva vedere come RNR fa l'equivalente di giocare con il fuoco senza scottarsi".
Il primo autore Kang dice che il rallentamento del trasferimento radicale ha permesso loro di osservare parti dell'enzima che nessuno era stato in grado di vedere prima completamente. "Prima di questo studio, sapevamo che questa danza molecolare stava accadendo, ma non avevamo mai visto la danza in azione, " dice. "Ma ora che abbiamo una struttura per RNR nel suo stato attivo, abbiamo un'idea molto migliore di come i diversi componenti dell'enzima si muovono e interagiscono per trasferire il radicale su lunghe distanze".
Sebbene questa danza molecolare metta insieme le subunità, c'è ancora una distanza considerevole tra loro:il radicale deve percorrere 35-40 angstrom dalla prima subunità alla seconda. Questo viaggio è circa 10 volte più lungo del trasferimento radicale medio, secondo Drennan. Il radicale deve quindi tornare al punto di partenza ed essere conservato in modo sicuro, il tutto entro una frazione di secondo prima che l'enzima ritorni alla sua normale conformazione.
Poiché l'RNR è un bersaglio per i farmaci che curano il cancro e alcuni virus, conoscere la sua struttura allo stato attivo potrebbe aiutare i ricercatori a ideare trattamenti più efficaci. La comprensione dello stato attivo dell'enzima potrebbe anche fornire informazioni sul trasporto biologico degli elettroni per applicazioni come i biocarburanti. Drennan e Kang sperano che il loro studio incoraggi gli altri a catturare eventi cellulari fugaci che sono stati difficili da osservare in passato.
"Potremmo aver bisogno di rivalutare decenni di risultati passati, "Drennan dice. "Questo studio potrebbe aprire più domande di quante ne risponda; è più un inizio che una fine".
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca del MIT, innovazione e didattica.