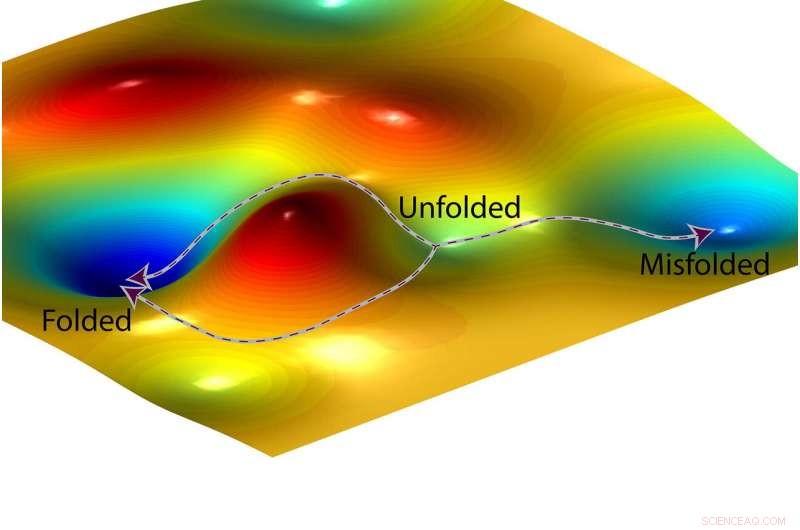
La rappresentazione di un artista di un paesaggio a energia libera e due possibili percorsi che una proteina potrebbe seguire (a sinistra) per piegarsi correttamente e un terzo percorso (a destra) che porta a uno stato mal ripiegato. Credito:O. Igoshin/Rice University
I ricercatori della Rice University hanno scoperto una simmetria nascosta nelle equazioni chimico-cinetiche che gli scienziati hanno usato a lungo per modellare e studiare molti dei processi chimici essenziali per la vita.
La scoperta ha implicazioni per la progettazione di farmaci, genetica e ricerca biomedica ed è descritta in uno studio pubblicato questo mese nel Atti dell'Accademia Nazionale delle Scienze . Per illustrare le ramificazioni biologiche, co-autori dello studio Oleg Igoshin, Anatoly Kolomeisky e Joel Mallory del Centro di Fisica Teorica Biologica (CTBP) di Rice hanno usato tre esempi di ampia portata:ripiegamento delle proteine, catalisi enzimatica ed efficienza delle proteine motorie.
In ogni caso, i ricercatori hanno dimostrato che un semplice rapporto matematico mostra che la probabilità di errori è controllata dalla cinetica piuttosto che dalla termodinamica.
"Potrebbe essere una proteina che si ripiega nella conformazione corretta rispetto a quella errata, un enzima che incorpora l'amminoacido giusto contro quello sbagliato nella catena polipeptidica, o una proteina motoria che fa un passo indietro per errore invece di andare avanti, " disse Igoshin, un investigatore CTBP e professore di bioingegneria alla Rice. "Tutte queste proprietà possono essere espresse come rapporto tra due flussi allo stato stazionario, e abbiamo scoperto che le proprietà biologiche espresse in questi termini sono sotto controllo cinetico".
L'esempio del ripiegamento delle proteine illustra le implicazioni per la progettazione di farmaci. Tutte le proteine si ripiegano in una forma caratteristica, e una frazione si piega male nella forma sbagliata. Il misfolding delle proteine è stato implicato in alcune malattie e malattie genetiche ereditarie, e i produttori di farmaci sono interessati a produrre farmaci in grado di ridurre le possibilità di ripiegamento errato delle proteine.
prima che si pieghi, una proteina ha energia, come una palla seduta in cima a una collina. Il pieghevole è la discesa da questo punto di partenza ad alta energia al punto in cui la palla smette di rotolare. I chimici usano spesso un aiuto visivo chiamato "paesaggio a energia libera" per tracciare i livelli di energia nelle reazioni chimiche. Il paesaggio sembra una catena montuosa con picchi e valli, e la discesa dal punto di partenza spiegato di una proteina al punto finale completamente piegato può sembrare una strada di montagna che si snoda attraverso una serie di valli. Anche se una città lungo la strada è più bassa in altezza, un viaggiatore potrebbe dover scalare colline per spostarsi da una valle all'altra lungo la strada in discesa.
"Abbiamo dimostrato che sono le barriere, i punti alti tra le valli, che determinano questi rapporti, " Igoshin ha detto. "Le profondità delle valli non contano.
"Se vuoi ottenere un farmaco che aiuti una proteina a ripiegarsi correttamente, Per esempio, la nostra previsione è che il farmaco deve essere in grado di ridurre una barriera lungo il percorso di piegatura, " disse. "Se riguarda solo le valli, diciamo migliorando la stabilità di alcune conformazioni intermedie lungo il percorso di piegatura, non cambierà il rapporto tra le volte in cui la proteina si ripiega correttamente e non in modo errato".
Igoshin ha affermato che il lavoro deriva da uno studio del 2017 in cui lui, Kolomeisky e l'ex ricercatore post-dottorato CTBP Kinshuk Banerjee hanno dimostrato che l'accuratezza della catalisi enzimatica era cineticamente controllata. Igoshin ha descritto la scoperta come "una sorta di simmetria sottostante delle equazioni".
"Se guardi i rapporti dei flussi, ottieni questa interessante cancellazione, e tutti i termini che hanno a che fare con questi valori si annullano, e ottieni l'invarianza, " ha detto. "Quando abbiamo ottenuto questo risultato per la prima volta, ci è sembrato controintuitivo. Quindi, non eravamo sicuri che fosse una coincidenza, perché nel lavoro precedente l'abbiamo mostrato solo per due particolari schemi cinetici. Ora il lavoro di Joel ha dimostrato che può essere generalizzato a questa vasta gamma di sistemi".
Igoshin ha detto che la simmetria "non era così difficile da dimostrare, ma nessuno se ne è accorto prima."
"Penso che sia un risultato fisico molto interessante che ha grandi implicazioni in biologia, ", ha detto. "Potrebbe aiutare a definire i limiti su ciò che è possibile in termini di controllo e ottimizzazione delle proprietà a livello di sistema in molti processi biologici".