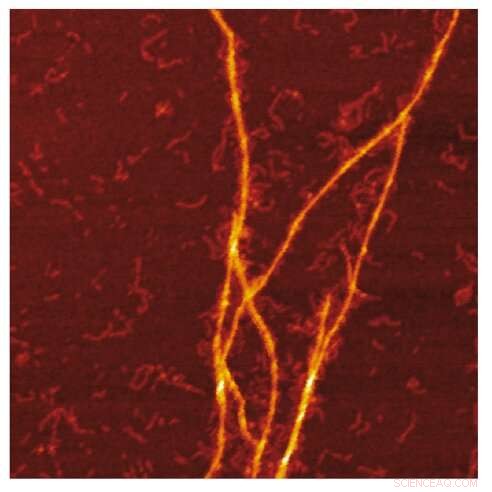
Immagine AFM della sagomatura amiloide delle fibrille S100A9 sulla superficie delle fibrille Aβ. Credito:Jonathan Pansieri
Un gruppo di ricerca guidato da Ludmilla Morozova Roche presso l'Università di Umeå, Svezia, ha fornito la visione meccanicistica della co-aggregazione proteica nella malattia di Alzheimer. Il meccanismo di modellazione degli amiloidi S100A9 sulle superfici fibrillari Aβ durante il processo di co-aggregazione è stato rivelato dalla sinergia di metodi biofisici tra cui la spettrometria di massa di rilevamento della carica, microscopia, analisi cinetiche e microfluidica.
La formazione di amiloide è di fondamentale importanza clinica poiché questo processo è coinvolto in numerose malattie neurodegenerative come l'Alzheimer, Parkinson e altri. Queste malattie colpiscono milioni di persone che invecchiano in tutto il mondo. Spesso è difficile tracciare una linea di demarcazione tra queste malattie o possono verificarsi contemporaneamente, nota come comorbilità della malattia.
Mentre il processo di formazione dell'amiloide è stato ampiamente studiato, poco si sa sui meccanismi specifici di co-aggregazione di diverse specie amiloidi insieme, alla base della comorbilità delle malattie. Nella malattia di Alzheimer, la cascata neuroinfiammatoria amiloide si manifesta nella co-aggregazione di Aβ con la proteina proinfiammatoria S100A9, che porta all'assemblaggio dell'amiloide intracellulare ed extracellulare, depositi di placca amiloide e tossicità cellulare.
Decifrare le interazioni tra la proteina proinfiammatoria S100A9 e il peptide Aβ42 nella malattia di Alzheimer è fondamentale poiché l'infiammazione gioca un ruolo centrale nell'insorgenza della malattia. Qui i ricercatori utilizzano l'innovativa spettrometria di massa a rilevamento di carica (CDMS) insieme a tecniche biofisiche per fornire informazioni meccanicistiche sul processo di co-aggregazione e differenziare i complessi amiloidi a livello di singola particella.
La combinazione delle distribuzioni di massa e di carica delle amiloidi insieme alla ricostruzione delle differenze tra loro e la microscopia dettagliata rivela che la co-aggregazione comporta la modellazione di fibrille S100A9 sulla superficie delle amiloidi Aβ42. L'analisi cinetica conferma ulteriormente che le superfici disponibili per la nucleazione secondaria di Aβ42 sono diminuite a causa del rivestimento di amiloidi S100A9, mentre il legame delle fibrille S100A9 con Aβ42 è convalidato da un test microfuidico.
I ricercatori dimostrano che la sinergia tra CDMS, microscopia, l'analisi cinetica e microfuidica apre nuove direzioni alla ricerca interdisciplinare.