
Un nuovo studio dell'Università di Princeton e dell'Università La Sapienza di Roma fornisce una forte evidenza per una controversa teoria secondo cui a temperature molto fredde l'acqua può esistere in due forme liquide distinte, uno è meno denso e più strutturato dell'altro. Credito:foto di John Salatas, Licenza Creative Commons
Acqua, così ordinario e così essenziale alla vita, agisce in modi che sono piuttosto sconcertanti per gli scienziati. Per esempio, perché il ghiaccio è meno denso dell'acqua, galleggiare piuttosto che affondare come fanno gli altri liquidi quando si congelano?
Ora un nuovo studio fornisce una forte evidenza per una controversa teoria secondo cui a temperature molto fredde l'acqua può esistere in due forme liquide distinte, uno è meno denso e più strutturato dell'altro.
I ricercatori dell'Università di Princeton e dell'Università La Sapienza di Roma hanno condotto simulazioni al computer di molecole d'acqua per scoprire il punto critico in cui una fase liquida si trasforma nell'altra. Lo studio è stato pubblicato questa settimana sulla rivista Scienza .
"La presenza del punto critico fornisce una spiegazione molto semplice delle stranezze dell'acqua, ", ha affermato il decano per la ricerca di Princeton Pablo Debenedetti, la classe 1950 Professore di Ingegneria e Scienze Applicate, e professore di ingegneria chimica e biologica. "Il ritrovamento del punto critico equivale a trovare un bene, semplice spiegazione per le tante cose che rendono l'acqua strana, soprattutto alle basse temperature."
Le stranezze dell'acqua includono che quando l'acqua si raffredda, si espande invece di contrarsi, ecco perché l'acqua congelata è meno densa dell'acqua liquida. L'acqua diventa anche più comprimibile, o comprimibile, a temperature più basse. Ci sono anche almeno 17 modi in cui le sue molecole possono organizzarsi quando congelate.
Un punto critico è un valore unico di temperatura e pressione al quale due fasi della materia diventano indistinguibili, e si verifica appena prima che la materia si trasformi da una fase all'altra.
Le stranezze dell'acqua sono facilmente spiegabili dalla presenza di un punto critico, Debenedetti ha detto. La presenza di un punto critico si avverte sulle proprietà della sostanza abbastanza lontano dal punto critico stesso. Nel punto critico, la compressibilità e altre misure termodinamiche del comportamento delle molecole, come la capacità termica, sono infiniti.
Utilizzando due diversi metodi di calcolo e due modelli informatici dell'acqua altamente realistici, il team ha identificato il punto critico liquido-liquido in un intervallo compreso tra circa 190 e 170 gradi Kelvin (da circa -117 gradi a -153 gradi Fahrenheit) a circa 2, 000 volte la pressione atmosferica al livello del mare.
L'individuazione del punto critico è un passo soddisfacente per i ricercatori coinvolti nella ricerca decennale per determinare la spiegazione fisica sottostante alle proprietà insolite dell'acqua. Diversi decenni fa, i fisici hanno teorizzato che raffreddare l'acqua a temperature inferiori al suo punto di congelamento mantenendola allo stato liquido, uno stato "sovraraffreddato" che si verifica nelle nuvole ad alta quota, avrebbe esposto le due forme liquide uniche dell'acqua a pressioni sufficientemente elevate.
Per testare la teoria, i ricercatori si sono rivolti alle simulazioni al computer. Gli esperimenti con molecole d'acqua reali non hanno finora fornito prove univoche di un punto critico, in parte a causa della tendenza dell'acqua superraffreddata a congelare rapidamente nel ghiaccio.
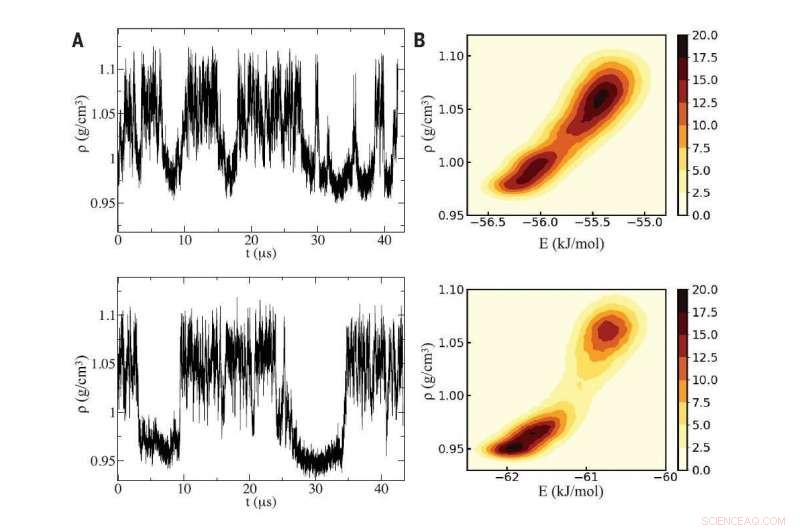
Fig A (a sinistra):utilizzo di due distinte simulazioni al computer dell'acqua (pannelli superiore e inferiore), i ricercatori hanno rilevato oscillazioni di densità caratteristiche dell'acqua sottoraffreddata che oscilla tra due fasi liquide che differiscono per densità. Fig B (a destra):Le simulazioni hanno rivelato un punto critico tra le due fasi liquide, le cui diverse densità hanno origine microscopicamente dall'intrusione di una molecola d'acqua in più nell'ambiente locale di una generica molecola centrale nel liquido ad alta densità. Credito:Ristampato con il permesso di PG Debenedetti et al, Scienza Vol 369 Edizione 6501, DOI:10.1126/science.abb9796
Francesco Sciortino, professore di fisica alla Sapienza Università di Roma, ha condotto uno dei primi studi di modellazione di questo tipo mentre era ricercatore post-dottorato nel 1992. Tale studio, pubblicato sulla rivista Natura , fu il primo a suggerire l'esistenza di un punto critico tra le due forme liquide.
La nuova scoperta è estremamente soddisfacente per Sciortino, che è anche coautore del nuovo studio in Scienza . Il nuovo studio ha utilizzato i computer di ricerca molto più veloci e potenti di oggi e modelli dell'acqua più nuovi e più accurati. Anche con i potenti computer di ricerca di oggi, le simulazioni hanno richiesto circa 1,5 anni di tempo di calcolo.
"Puoi immaginare la gioia quando abbiamo iniziato a vedere le fluttuazioni critiche comportarsi esattamente come avrebbero dovuto, — disse Sciortino. — Adesso dormo bene, perché dopo 25 anni, la mia idea originale è stata confermata."
Nel caso delle due forme liquide dell'acqua, le due fasi coesistono in precario equilibrio a temperature inferiori allo zero ea pressioni sufficientemente elevate. Man mano che la temperatura scende, le due fasi liquide si impegnano in un tiro alla fune finché una non vince e l'intero liquido diventa a bassa densità.
Nelle simulazioni eseguite dal ricercatore postdottorato Gül Zerze a Princeton e Sciortino a Roma, poiché hanno abbassato la temperatura ben al di sotto dello zero nell'intervallo superraffreddato, la densità dell'acqua oscillava selvaggiamente proprio come previsto.
È probabile che alcuni degli strani comportamenti dell'acqua siano alla base delle proprietà vivificanti dell'acqua, disse Zerzè. "Il fluido della vita è l'acqua, ma ancora non sappiamo esattamente perché l'acqua non sia sostituibile con un altro liquido. Pensiamo che la ragione abbia a che fare con il comportamento anomalo dell'acqua. Altri liquidi non mostrano quei comportamenti, quindi questo deve essere collegato all'acqua come il liquido della vita."
Le due fasi dell'acqua si verificano perché la forma della molecola d'acqua può portare a due modi di impacchettarsi insieme. Nel liquido a bassa densità, quattro molecole si raggruppano attorno a una quinta molecola centrale in una forma geometrica chiamata tetraedro. Nel liquido a maggiore densità, una sesta molecola si infila dentro, che ha l'effetto di aumentare la densità locale.
Il team ha rilevato il punto critico in due diversi modelli computerizzati dell'acqua. Per ogni modello, i ricercatori hanno sottoposto le molecole d'acqua a due diversi approcci computazionali per cercare il punto critico. Entrambi gli approcci hanno portato alla scoperta di un punto critico.
Pietro Poole, professore di fisica alla St. Francis Xavier University in Canada, e uno studente laureato quando ha collaborato con Sciortino e coautore del documento del 1992 in Nature, ha detto che il risultato è stato soddisfacente. "È molto confortante avere questo nuovo risultato, " Ha detto. "È stata una lunga e talvolta solitaria attesa dal 1992 per vedere un altro caso inequivocabile di una transizione di fase liquido-liquido in un modello realistico dell'acqua".
C. Austen Angell, Regents Professor presso l'Arizona State University, è uno dei pionieri degli esperimenti degli anni '70 sulla natura dell'acqua superraffreddata. "Non c'è dubbio che questo è uno sforzo eroico nella simulazione della fisica dell'acqua con un molto interessante, e benvenuto, conclusione, " disse Angelo, che non è stato coinvolto nel presente studio, in una e-mail. "Come sperimentatore con accesso a misurazioni fisiche di equilibrio (a lungo termine) sull'acqua reale, Mi ero sempre sentito "al sicuro" dalla prelazione da parte dei simulatori di computer. Ma i dati presentati nel nuovo documento mostrano che questo non è più vero".