Credito:Università dell'Oregon
Gli scienziati sanno da decenni che una certa classe di enzimi è un attore importante nella biologia cellulare perché spesso mutano e diventano i principali responsabili del cancro.
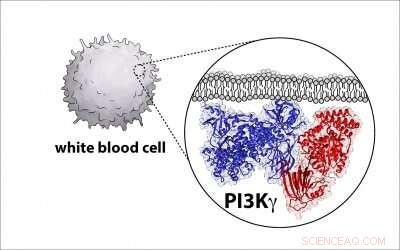
Le aziende biofarmaceutiche stanno cercando di sviluppare farmaci che colpiscano e inattivino questi enzimi, noto come fosfoinositide 3-chinasi, o PI3K in breve, a causa del loro ruolo nel causare il cancro negli esseri umani. Ma per farlo, gli scienziati hanno bisogno di un progetto dettagliato dell'architettura enzimatica, e il professore di biochimica dell'UO Scott Hansen fa parte di un gruppo che scopre quel diagramma.
Hansen, professore assistente presso l'UO Dipartimento di Chimica e Biochimica, detta parte della sfida è che le molecole sono complesse, con due grandi proteine che si uniscono e formano un complesso.
"Quindi è davvero difficile capire qual è la struttura e l'organizzazione di questa proteina, " ha detto. "Un prerequisito per lo sviluppo di un farmaco è imparare come il farmaco si lega alla molecola. Hai bisogno di un progetto della proteina su cui agganciare quel farmaco".
Ora Hansen e colleghi di diverse altre università hanno sviluppato un tale progetto per PI3K e hanno identificato dove una proteina regolatrice fondamentale si lega all'enzima, una scoperta con il potenziale per aiutare a rafforzare lo sforzo di costruire farmaci antitumorali più specifici.
"Questo modellerà sicuramente il modo in cui le persone pensano allo sviluppo di terapie contro il cancro, " Egli ha detto.
Hansen è uno dei 13 coautori dell'articolo pubblicato sulla rivista Progressi scientifici , insieme ai colleghi delle università di Victoria, British Columbia, Washington e Ginevra, e Vrije Universiteit Brussel in Belgio.
Ciò che rende unico il documento è "informazioni strutturali a risoluzione più elevata e la capacità di misurare le interazioni biologicamente rilevanti con altre molecole nel definire la sequenza e la priorità delle interazioni, "Ha detto Hansen.
Ma ha detto che resta ancora molto lavoro per capire meglio come altre molecole si legano alla proteina e ne modulano la funzione.
Per conoscere la struttura dell'enzima, i ricercatori hanno utilizzato una tecnica chiamata microscopia crioelettronica, che raccoglie decine di migliaia di immagini di singoli enzimi P13K in uno strato di ghiaccio ultrasottile utilizzando un microscopio elettronico. Le immagini vengono compilate e mediate per creare un'unica immagine ad alta risoluzione che riveli le caratteristiche strutturali dell'enzima.
In questo caso, la struttura dell'enzima era diversa da quanto si pensasse in precedenza. Il nuovo progetto consentirà ai ricercatori di definire come altre molecole attivano la proteina.
"Molte volte facciamo ricerche e otteniamo indizi su come sono organizzate le proteine o osserviamo le strutture di molecole correlate ed estrapoliamo, ma a volte queste ipotesi sono imprecise e possono condurre un campo sulla strada sbagliata, "Ha detto Hansen. "Avere un progetto ad alta risoluzione dell'organizzazione delle molecole consente alle persone di sviluppare farmaci specifici solo per quella molecola".
Hansen ha affermato che i ricercatori coinvolti nel documento hanno trascorso 10 anni a lavorare sul problema.
"Non è raro per le proteine davvero complicate, " Egli ha detto.
Hansen ha affermato che il suo laboratorio presso l'UO e il laboratorio di John Burke presso l'Università della British Columbia conducono ricerche complementari. Il laboratorio di Burke utilizza la microscopia crioelettronica per ottenere immagini ad alta risoluzione di molecole, e il laboratorio di Hansen è in grado di "eseguire misure più dinamiche che ci consentono di misurare le interazioni di questo enzima e altri fattori critici per l'attivazione".
Ha detto che è entusiasmante collaborare con altri scienziati che hanno esperienza in aree che lui non ha.
"Sempre più, per realizzare le nostre ambizioni di ricerca non possiamo semplicemente fare affidamento sulle competenze del nostro laboratorio, " ha detto. "I problemi stanno diventando troppo complicati e devi affrontarli da diverse angolazioni e integrare molte competenze diverse".