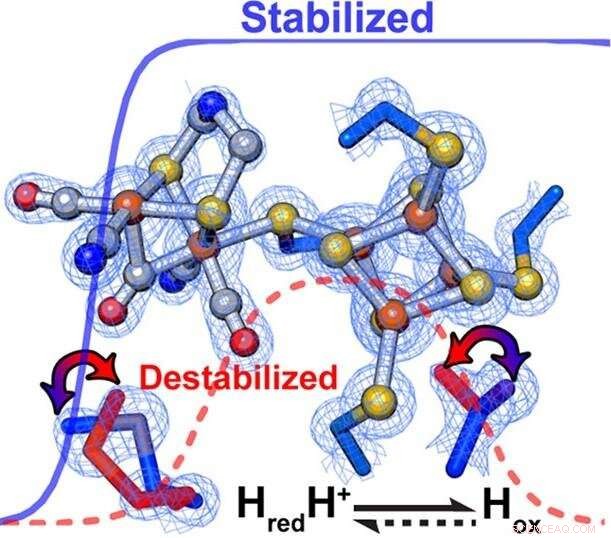
I ricercatori hanno scoperto che sottili cambiamenti nell'impalcatura proteica che circonda il centro catalitico di un enzima controllano in modo squisito la velocità e la direzione delle reazioni chimiche. All'interno di [FeFe]-idrogenasi, le interazioni secondarie hanno influenzato direttamente la relativa stabilizzazione/destabilizzazione di diversi stati di ossidazione del cluster metallico del sito attivo. Attestazione:PNNL
Mentre i ricercatori cercano modi per sviluppare e migliorare i prodotti di uso quotidiano che vanno dal carburante ai medicinali, gli enzimi forniscono l'esempio della natura del controllo necessario per far funzionare le reazioni chimiche nei modi desiderati. Ma un fenomeno noto come bias catalitico continua a lasciare perplessi gli scienziati.
L'impalcatura proteica attorno al nucleo catalitico di un enzima controlla in modo squisito la reattività, compresa la direzione e la velocità dei processi chimici. Gli scienziati si riferiscono a questa messa a punto come "pregiudizio catalitico" e il modo in cui si verifica rimane ampiamente dibattuto.
Il mistero è a un passo dalla soluzione.
Un team di ricerca di tre laboratori nazionali del Dipartimento dell'Energia degli Stati Uniti (DOE) e quattro università ha scoperto che sottili cambiamenti nell'ambiente che circonda alcuni enzimi non solo possono cambiare la velocità di una reazione cellulare di ben sei ordini di grandezza, ma anche la sua direzione. Quell'inversione - la radice del dilemma del pregiudizio catalitico - è come accelerare in una direzione a 10 miglia al secondo, poi andando nella direzione opposta a 1, 000, 000 miglia al secondo. Il divario si somma rapidamente.
"A seconda del risultato desiderato, il pregiudizio potrebbe essere insormontabile o una delle cose migliori che possa mai accadere, " ha detto Simone Raugei, uno scienziato computazionale al PNNL e coautore dello studio. "Una reazione può avere molti intermedi e può seguire più percorsi, alcuni più efficienti di altri. Quindi, essere in grado di regolare l'ambiente del catalizzatore può fare una notevole differenza nella velocità di reazione".
Le scoperte, riportato in Giornale della Società Chimica Americana , hanno implicazioni significative per la progettazione di catalizzatori sintetici utilizzati in ambienti industriali, dove la previsione e il controllo del comportamento di una reazione è fondamentale. I risultati forniscono anche una maggiore comprensione fondamentale dei fattori che controllano i processi metabolici in tutta la vita.
Bias catalitico nei metalloenzimi
In natura, il microbo Clostridium pasteurianum (Cp) produce numerosi enzimi a base di ferro, [FeFe]-idrogenasi, che fanno parte di un ampio gruppo di metalloenzimi. I metalloenzimi sono coinvolti in una moltitudine di reazioni che svolgono molte funzioni, come spostare l'idrogeno attraverso le comunità microbiche, afferrando azoto dall'aria, produzione di metano, e la conversione dei carboidrati.
La versatilità rende i metalloenzimi, e [FeFe]-idrogenasi in particolare, argomenti ideali per approfondire questioni fondamentali relative alle trasformazioni chimiche. Infatti, le idrogenasi sono state la fonte di ispirazione per numerosi studi di elettrocatalisi nelle reazioni di conversione dell'energia finanziati attraverso l'Office of Basic Energy Sciences del DOE, disse Morris Bullock, direttore del Centro per l'elettrocatalisi molecolare, un DOE Energy Frontier Research Center.
"Le scoperte riportate da diversi gruppi di ricerca che utilizzano approcci complementari arricchiscono la nostra comprensione delle basi scientifiche fondamentali della catalisi da parte di sistemi sia biologici che molecolari, " disse Bullock.
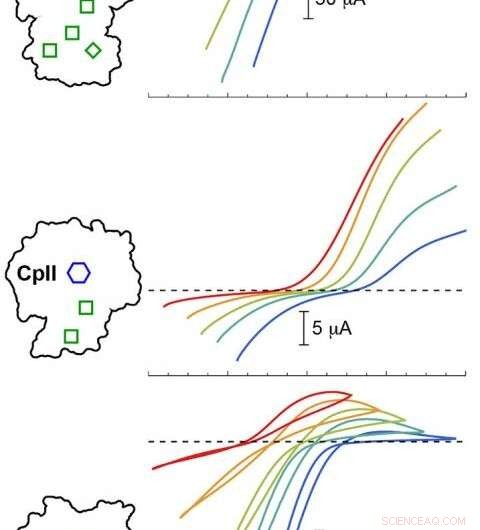
La modellazione computazionale PNNL ha convalidato gli esperimenti con tre idrogenasi Cp a diversi valori di pH. I risultati hanno mostrato che il potenziale catalitico (curve colorate) variava a seconda della disposizione del cluster H (esagono blu) e dei cluster accessori (scatole verdi). Le tracce colorate sotto la linea tratteggiata corrispondono alla produzione di idrogeno, mentre le tracce sopra la linea tratteggiata corrispondono all'ossidazione dell'idrogeno. Credito: Marmellata. chimica. Soc . 2020, 142, 3, 1227-1235
John Peters, nominato congiuntamente dal PNNL, è professore alla Washington State University (WSU) e direttore di Biological and Electron Transfer and Catalysis, un altro DOE Energy Frontier Research Center. Peters ha iniziato a studiare le [FeFe]-idrogenasi alla fine degli anni '90 utilizzando enzimi trovati nel microbo Cp. Ma quegli studi precedenti si concentravano su aspetti meccanicistici generali, e solo di recente i ricercatori hanno iniziato a pensare agli enzimi nel contesto del bias catalitico.
Peters e Paul King, responsabile del gruppo di biochimica fisica e fotosintesi presso il National Renewable Energy Laboratory (NREL), ha co-progettato il nuovo studio con Raugei al PNNL e Anne Jones, professore associato presso la School of Molecular Sciences dell'Arizona State University (ASU).
Lo studio mirava a identificare come tre [FeFe]-idrogenasi differiscono nel controllo sia della riduzione dei protoni a idrogeno molecolare, così come la reazione inversa:ossidazione dell'idrogeno molecolare a protoni. Ogni cosiddetta reazione redox svolge un ruolo critico nel trasferimento di energia biologica ed è stata ampiamente studiata per applicazioni di produzione e stoccaggio di energia.
L'elettrostatica mette a punto gli intermedi di reazione
Lo studio dell'attività catalitica delle tre idrogenasi [FeFe] ha comportato una potente combinazione di approcci sperimentali presso numerose strutture di ricerca ed è stato eseguito da scienziati della WSU, NREL e ASU. Raugei, anche un delegato congiunto presso WSU, ha guidato il team di modellazione teorica e computazionale, il cui compito era quello di ordinare le osservazioni sperimentali e sviluppare un modello teorico per il meccanismo enzimatico.
Il team di ricerca ha utilizzato misurazioni precise dai raggi X presso la struttura Linac Coherent Light Source, situato presso la Stanford Synchrotron Radiation Lightsource, analizzare la struttura atomica dell'enzima. Prossimo, i ricercatori dell'ASU hanno sottoposto l'enzima a una corrente elettrica per esaminare l'attività elettrocatalitica di ciascuna idrogenasi sia nello stato di riposo che in quello attivo. Tutti gli enzimi condividevano un identico cluster catalitico di atomi di ferro e zolfo, generalmente chiamato H-Cluster, ma differivano nella composizione dell'ambiente proteico circostante.
I ricercatori hanno notato differenze significative nel bias di reazione tra le tre idrogenasi. Quindi, durante i cicli di feedback tra gli esperimenti e la modellazione computazionale, sottili cambiamenti nel campo elettrostatico attorno al centro catalitico hanno attirato l'attenzione del team.
"Abbiamo visto infatti che se il campo fosse cambiato, siamo stati in grado di guidare la reazione in modo più favorevole in un modo o nell'altro per cercare di spiegare l'osservazione sperimentale, " disse Raugei. Le sottili differenze nell'ambiente, Egli ha detto, determinato la direzione della reazione in condizioni stazionarie e messo a punto la velocità di reazione.
Secondo Re, la stabilizzazione o destabilizzazione selettiva di intermedi catalitici ha favorito preferenzialmente l'ossidazione dell'idrogeno o la riduzione del protone. Nello specifico, un ambiente più idrofobo che circonda l'H-Cluster ha sintonizzato l'enzima per favorire preferenzialmente la produzione di idrogeno, mentre l'ossidazione dell'idrogeno è stata favorita da un ambiente meno idrofobo.
"Questo lavoro, " disse Re, "rivela il potere della biologia di controllare la reattività dei metalloenzimi per soddisfare i processi metabolici unici in tutta la vita e fornisce nuove preziose informazioni per la progettazione di piattaforme elettrocatalitiche migliorate".
Peters ha affermato che le caratteristiche di progettazione utilizzate dalle [FeFe]-idrogenasi per regolare e controllare la reattività sono probabilmente condivise tra altri biocatalizzatori di siti metallici. I ricercatori intendono perfezionare il loro modello per fornire un modello più generale per comprendere il pregiudizio catalitico nella classe più ampia di enzimi redox e l'energia metabolica che guida tutta la vita.