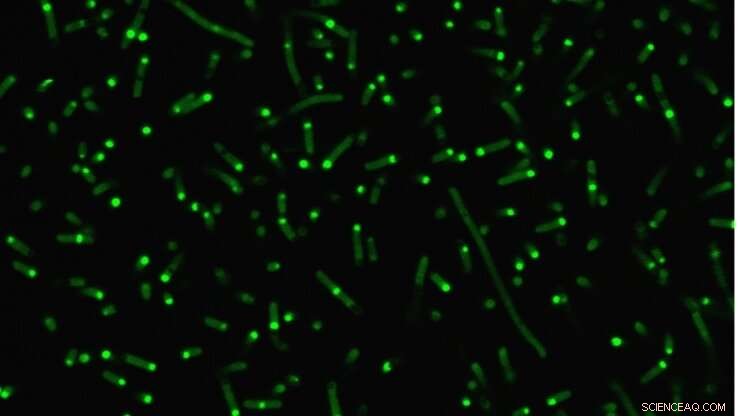
Le proteine intrinsecamente disordinate (verde fluorescente) si aggregano all'interno delle cellule per formare organelli artificiali. Credito:Duke University
Gli ingegneri biomedici della Duke University hanno dimostrato un metodo per controllare la separazione di fase di una classe emergente di proteine per creare organelli artificiali senza membrana all'interno delle cellule umane. Il vantaggio, simile al controllo di come l'aceto forma le goccioline nell'olio, crea opportunità per l'ingegneria di strutture sintetiche per modulare le funzioni cellulari esistenti o creare comportamenti completamente nuovi all'interno delle cellule.
I risultati appaiono online il 3 agosto sulla rivista Chimica della natura .
Le proteine funzionano ripiegandosi in forme 3D specifiche che interagiscono con diverse strutture biomolecolari. I ricercatori in precedenza credevano che le proteine avessero bisogno di queste forme fisse per funzionare. Ma negli ultimi due decenni, è stata scoperta una nuova grande classe di proteine intrinsecamente disordinate (IDP) che hanno grandi regioni che sono "floppy", cioè, non si piegano in una forma tridimensionale definita. È ormai chiaro che queste regioni svolgono un ruolo importante, ruolo precedentemente non riconosciuto nel controllo di varie funzioni cellulari.
Gli IDP sono utili anche per applicazioni biomediche perché possono subire transizioni di fase, passando da un liquido a un gel, Per esempio, o da uno stato solubile a uno stato insolubile, e viceversa, in risposta a fattori scatenanti ambientali, come i cambiamenti di temperatura. Queste caratteristiche dettano anche il loro comportamento di fase negli ambienti cellulari e sono controllate regolando le caratteristiche degli IDP come il loro peso molecolare o la sequenza in cui gli amminoacidi sono collegati tra loro.
"Sebbene ci siano molti IDP naturali che mostrano un comportamento di fase nelle cellule, ne esistono di tanti gusti diversi, ed è stato difficile discernere le regole che governano questo comportamento, " disse Ashutosh Chilkoti, il Professore distinto di ingegneria biomedica di Alan L. Kaganov alla Duke. "Questo documento fornisce principi di ingegneria molto semplici per programmare questo comportamento all'interno di una cellula".
"Altri nel campo hanno adottato un approccio dall'alto verso il basso in cui modificheranno un IDP naturale e vedranno come cambia il suo comportamento all'interno di una cellula, " ha detto Michael Dzuricky, un ricercatore che lavora nel laboratorio di Chilkoti e primo autore dello studio. "Stiamo adottando l'approccio opposto e costruendo i nostri IDP artificiali da semplici principi termodinamici. Ciò consente a noi e ad altri di mettere a punto con precisione una singola proprietà, la forma del diagramma di fase degli IDP, per capire meglio come questo parametro influisce sul comportamento biologico"
Nel nuovo giornale, i ricercatori iniziano guardando alla natura per esempi di IDP che si uniscono per formare "condensati biomolecolari" all'interno delle cellule. Queste strutture debolmente tenute insieme consentono alle cellule di creare compartimenti senza anche costruire una membrana per incapsularle. Usando come base uno di questi IDP del comune moscerino della frutta, i ricercatori attingono dalla loro lunga storia di lavoro con gli sfollati interni per progettare una versione artificiale molecolarmente più semplice che mantenga lo stesso comportamento.
Questa versione più semplice ha permesso ai ricercatori di apportare modifiche precise al peso molecolare dell'IDP e degli amminoacidi degli IDP. I ricercatori mostrano che, a seconda di come queste due variabili sono ottimizzate, gli IDP si uniscono per formare questi compartimenti a diverse temperature in una provetta. E provando costantemente varie regolazioni e temperature, i ricercatori hanno acquisito una solida comprensione di quali parametri di progettazione sono più importanti per controllare il comportamento dell'IDP.
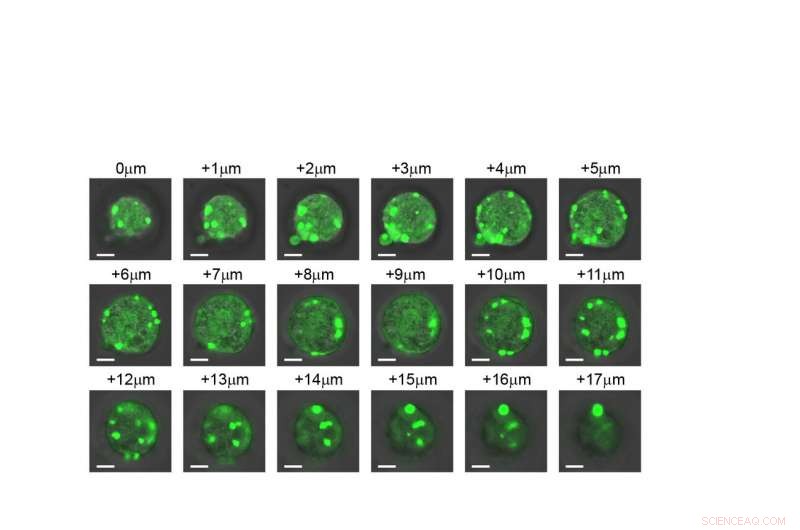
Una vista fetta per fetta di una cellula che mostra che gli organelli artificiali si formano in tutta la struttura. Credito:Duke University
Una provetta, però, non è la stessa cosa di una cellula vivente, quindi i ricercatori hanno fatto un ulteriore passo avanti per dimostrare come si comportano i loro IDP ingegnerizzati all'interno di E. coli. Come previsto, i loro IDP artificiali si sono raggruppati per formare una minuscola gocciolina all'interno del citoplasma della cellula. E poiché il comportamento dell'IDP era ora così ben compreso, i ricercatori hanno dimostrato di poter controllare in modo prevedibile il modo in cui si sono uniti utilizzando i loro principi in provetta come guida.
"Siamo stati in grado di modificare le temperature nelle cellule per sviluppare una descrizione completa del loro comportamento di fase, che rispecchiava le nostre previsioni in provetta, " disse Dzuricky. "A questo punto, siamo stati in grado di progettare diversi sistemi IDP artificiali in cui le goccioline che si formano hanno proprietà del materiale diverse".
Dirlo in un altro modo, perché i ricercatori hanno capito come manipolare le dimensioni e la composizione degli IDP per rispondere alla temperatura, potrebbero programmare gli IDP per formare goccioline o compartimenti di densità variabile all'interno delle cellule. Per mostrare come questa capacità potrebbe essere utile agli ingegneri biomedici, i ricercatori hanno quindi utilizzato le loro nuove conoscenze, come spesso fa la natura, per creare un organello che svolge una funzione specifica all'interno di una cellula.
I ricercatori hanno dimostrato di poter utilizzare gli IDP per incapsulare un enzima per controllarne il livello di attività. Variando il peso molecolare degli IDP, gli IDP trattengono l'enzima o sono aumentati o diminuiti, che a sua volta influenzava quanto potesse interagire con il resto della cellula.
Per dimostrare questa capacità, i ricercatori hanno scelto un enzima utilizzato da E. coli per convertire il lattosio in zuccheri utilizzabili. Però, in questo caso, i ricercatori hanno monitorato l'attività di questo enzima con un reporter fluorescente in tempo reale per determinare come l'organello IDP ingegnerizzato stava influenzando l'attività dell'enzima.
Nel futuro, i ricercatori ritengono di poter utilizzare i loro nuovi organelli IDP per controllare i livelli di attività delle biomolecole importanti per gli stati patologici. O per imparare come gli sfollati interni naturali ricoprono ruoli cellulari simili e capire come e perché a volte non funzionano correttamente.
"Questa è la prima volta che qualcuno è stato in grado di definire con precisione come la sequenza proteica controlla il comportamento di separazione di fase all'interno delle cellule, " ha detto Dzuricky. "Abbiamo usato un sistema artificiale, ma pensiamo che le stesse regole si applichino agli sfollati interni naturali e siamo entusiasti di iniziare a testare questa teoria".
"Ora possiamo anche iniziare a programmare questo tipo di comportamento di fase con qualsiasi proteina in una cellula fondendole con questi IDP artificiali, " ha detto Chilkoti. "Ci auguriamo che questi IDP artificiali forniranno un nuovo strumento per la biologia sintetica per controllare il comportamento delle cellule".