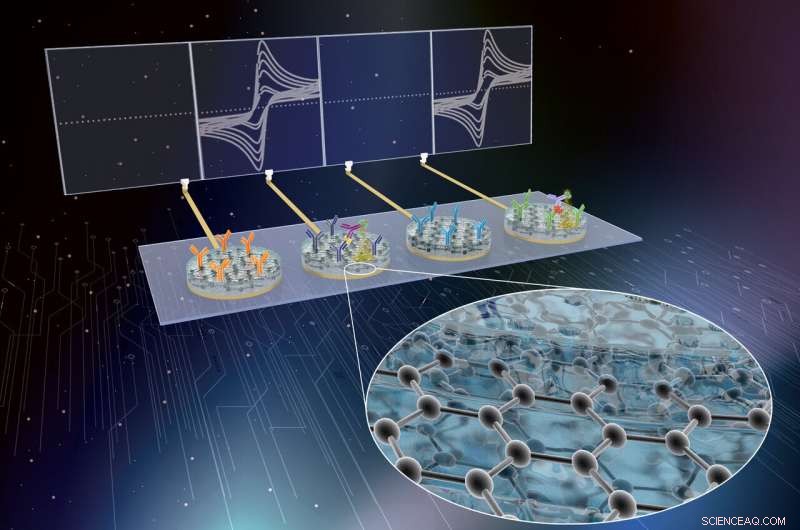
I ricercatori del Wyss Institute hanno sviluppato la tecnologia eRapid come tecnologia basata sull'affinità, piattaforma di sensori diagnostici elettrochimici a basso costo per il rilevamento multiplex di biomarcatori di sepsi clinicamente rilevanti nel sangue intero. Credito:Wyss Institute presso l'Università di Harvard
Molte condizioni mediche pericolose per la vita, come la sepsi, che è innescato da agenti patogeni trasmessi per via ematica, non può essere rilevato con precisione e abbastanza rapidamente per iniziare il giusto corso di trattamento. Nei pazienti che sono stati infettati da un patogeno sconosciuto e progrediscono verso una sepsi conclamata, ogni ora in più in cui non è possibile somministrare un antibiotico efficace aumenta significativamente il tasso di mortalità, quindi il tempo è della massima essenza.
La sfida con la diagnosi rapida della sepsi deriva dal fatto che la misurazione di un solo biomarcatore spesso non consente una diagnosi chiara. Gli ingegneri hanno lottato per decenni per quantificare simultaneamente più biomarcatori nel sangue intero con elevata specificità e sensibilità per applicazioni diagnostiche point-of-care (POC) in quanto ciò eviterebbe fasi di elaborazione del sangue lunghe e costose in cui le molecole di biomarcatori informativi potrebbero potenzialmente essere perse .
Ora, un team multidisciplinare presso il Wyss Institute for Biologically Inspired Engineering di Harvard e l'Università di Bath, UK, guidato dal direttore fondatore di Wyss Donald Ingber, M.D., dottorato di ricerca, e Wyss Senior Staff Scientist Pawan Jolly, dottorato di ricerca, ha ulteriormente sviluppato la tecnologia eRapid dell'Istituto come tecnologia basata sull'affinità, piattaforma di sensori diagnostici elettrochimici a basso costo per il rilevamento multiplex di biomarcatori clinicamente rilevanti nel sangue intero. Il dispositivo utilizza un nuovo rivestimento superficiale a base di nanocomposito di grafene ed è stato dimostrato che rileva con precisione tre diversi biomarcatori di sepsi contemporaneamente. I risultati sono riportati in Materiali funzionali avanzati .
"In questo studio, abbiamo compiuto un passo importante verso l'implementazione della nostra piattaforma di sensori elettrochimici in ambienti clinici per il rilevamento rapido e sensibile di più analiti nel sangue intero umano. Poiché il rivestimento in nanocomposito che abbiamo sviluppato qui è poco costoso, ha il potenziale per rivoluzionare la diagnostica point-of-care non solo per testare i biomarcatori della sepsi, ma una gamma molto più ampia di biomarcatori che possono essere multiplexati in set per riferire sugli stati di molte malattie e condizioni, "disse Ingber, che è anche a capo della piattaforma Bioinspired Therapeutics and Diagnostics del Wyss Institute, e il professore di biologia vascolare Judah Folkman presso la Harvard Medical School e il Boston Children's Hospital, e Professore di Bioingegneria presso SEAS.
Ingber, Jolly e il loro team Wyss stanno attualmente sviluppando sensori elettrochimici eRapid con il rivestimento nanocomposito a base di grafene di nuova concezione come componente critico di una diagnostica point-of-care per COVID, trauma cranico, infarto miocardico, e molti altri disturbi.
Sviluppando la loro tecnologia di rilevamento della sepsi elettrochimica, Il team di Ingber si è basato su lavori precedenti pubblicati su Nanotecnologia della natura , in cui avevano risolto il problema del "biofouling" con elementi di rilevamento elettrochimici con la loro tecnologia eRapid. In teoria, i biosensori elettrochimici sarebbero preferiti per molte applicazioni cliniche a causa della loro capacità di quantificare il contenuto di campioni biologici convertendo direttamente l'evento di legame di un biomarcatore in un segnale elettronico, il loro basso consumo energetico e costo, e facile integrazione con lettori diagnostici. Però, soprattutto quando si usa sangue intero, molti componenti del sangue si legano in modo aspecifico ai rivestimenti superficiali degli elettrodi dei sensori e portano alla loro degradazione, così come il rumore elettrico sotto forma di falsi segnali.
La tecnologia eRapid del team utilizza un nuovo rivestimento nanocomposito antivegetativo per elettrodi a cui sono attaccati reagenti leganti che catturano molecole di biomarcatori da piccole quantità di sangue e altri fluidi biologici complessi. Dopo aver rilevato chimicamente una qualsiasi di queste molecole di biomarcatori con elevata sensibilità e selettività, la piattaforma eRapid genera un segnale elettrico agli elettrodi che si correla in forza con i livelli delle molecole bersaglio che vengono rilevate. Il rivestimento iniziale in nanocomposito ha consentito un'eccellente conversione dei segnali chimici in segnali elettrici, e si basava su minuscoli nanofili d'oro elettricamente conduttivi incorporati in una matrice di una proteina reticolata nota come albumina di siero bovino. Però, gli alti costi dei materiali in oro erano stati la principale barriera alla commercializzazione di eRapid per applicazioni cliniche.
"Nella nostra versione avanzata di eRapid, abbiamo sostituito i nanofili d'oro del rivestimento con nanoscaglie di ossido di grafene che hanno anche proprietà antifouling ed elettrochimiche, ma sono molto meno costosi e consentono misurazioni ancora più sensibili. Infatti, i costi di fabbricazione del nanocomposito sono stati ridotti a una frazione del suo costo originale, che insieme alla velocità della tecnologia di rilevamento, efficienza, e la versatilità dovrebbero consentire alla piattaforma eRapid di avere un impatto commerciale immediato, " disse Jolly.
Dopo aver ottimizzato e caratterizzato il loro rivestimento nanocomposito in saggi di legame per la citochina infiammatoria interleuchina 6, il team lo ha applicato alla diagnosi di sepsi. Essenzialmente, attaccando una molecola anticorpale al rivestimento che lega la procalcitonina (PCT), e l'aggiunta di un secondo anticorpo specifico per PCT al complesso che è legato a un enzima, da un substrato chimico si forma un precipitato che si deposita sul rivestimento. Questo cambia la corrente degli elettroni che raggiungono l'elettrodo, e aiuta a registrare l'evento di associazione PCT come segnale elettronico.
"Abbiamo dimostrato che questo elemento sensore elettrochimico può rilevare la PCT con elevata precisione nel sangue intero, e lo ha convalidato quantificando i livelli di PCT in 21 campioni clinici, confrontandolo direttamente con un test ELISA convenzionale, con un'eccellente correlazione, " disse il primo autore Uroš Zupančič, che era uno studioso in visita nel gruppo di Ingber dall'Università di Bath. Zupančič è un dottorato di ricerca. candidato guidato dai coautori dello studio Despina Moschou, dottorato di ricerca, un docente presso l'Università di Bath, e Pedro Estrella, dottorato di ricerca, Professore associato e direttore del Centro per i biosensori, Bioelettronica e Biodispositivi all'Università.
Il team ha quindi esteso il proprio approccio alla rilevazione simultanea di più biomarcatori di sepsi progettando anche elementi sensore per la proteina C-reattiva, un altro biomarcatore della sepsi, e modelli molecolari associati ai patogeni (PAMP). L'elemento sensore PAMP in particolare sfrutta la tecnologia di cattura dei patogeni ad ampio spettro del Wyss Institute che utilizza una proteina geneticamente modificata chiamata FcMBL, che lega più di 100 diversi agenti patogeni di tutte le classi, così come le molecole sulle loro superfici che vengono rilasciate nel sangue quando i patogeni vengono uccisi (PAMP) e agiscono per innescare la cascata della sepsi.
"L'assemblaggio di tre sensori elettrochimici dedicati per i biomarcatori che possono essere presenti nel sangue a concentrazioni molto diverse su un singolo chip ha rappresentato una sfida significativa. Tuttavia, i tre elementi nel sensore finale hanno mostrato risposte specifiche all'interno dell'intervallo clinicamente significativo senza interferire l'uno con l'altro, e lo hanno fatto con un tempo di risposta di 51 minuti, che soddisfa l'esigenza clinica di diagnosi di sepsi entro la prima ora, " disse Zumpancič.
Per rendere l'attuale tecnologia eRapid ancora più efficace e utile per l'analisi dei campioni clinici, il team lo ha integrato con un sistema microfluidico che elimina l'elemento umano coinvolto nella manipolazione del sensore in laboratorio, e aumenta il numero di eventi di legame dei biomarcatori sulla sua superficie. Ciò consente di automatizzare l'analisi dei biomarcatori con il sistema, e ha permesso ai ricercatori di ridurre il tempo di risposta per la misurazione della PCT a 7 minuti.