Credito: Scienze chimiche (2020). DOI:10.1039/D0SC04993J
Gli scienziati hanno scoperto la prima prova del ripiegamento proteico guidato dalla separazione di fase liquido-liquido, un fenomeno in cui i fluidi si formano in goccioline microscopiche e si separano all'interno delle cellule, come gocce di olio nell'acqua.
In uno studio pubblicato sulla rivista Scienze chimiche , i ricercatori dell'Università di Notre Dame hanno scoperto che elevate concentrazioni di proteine all'interno delle goccioline hanno innescato un evento di ripiegamento, aumentando il potenziale di aggregazione proteica, o misfolding, che è stato collegato a malattie neurologiche tra cui il morbo di Alzheimer e la sclerosi laterale amiotrofica (SLA).
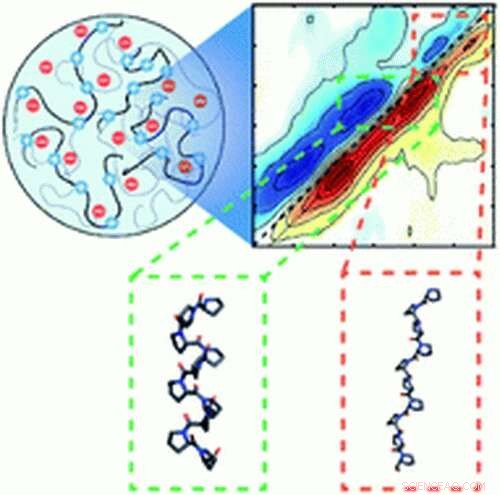
"Queste particolari proteine sono intrinsecamente disordinate, non hanno una struttura ben definita, ma quando vengono forzate insieme da queste goccioline, vediamo prove di piegatura, " disse Arnaldo Serrano, assistente professore presso il Dipartimento di Chimica e Biochimica di Notre Dame e ricercatore principale dello studio. Le proteine sono naturalmente informe, come pezzi di spaghetti cotti e funzionano solo quando piegati in specifici, strutture tridimensionali. "Immagina di essere in mezzo alla folla, e tutti nella folla hanno le braccia tese. Non starai molto bene insieme. Tiri dentro le braccia, e magari unire le mani. Quando diventa affollato, queste proteine si condensano in una struttura ripiegata".
Negli anni, ricercatori hanno studiato come le goccioline microscopiche, formandosi naturalmente e spontaneamente all'interno delle strutture cellulari, svolgere molteplici funzioni. Le cellule possono dirigere e contenere biomateriali pericolosi all'interno dei compartimenti fluidi per proteggere la cellula dai danni. Ci sono anche prove che possono guidare varie reazioni chimiche come l'aggregazione proteica.
Nel loro studio, Serrano e il suo team hanno utilizzato la spettroscopia a infrarossi per misurare il ripiegamento di una specifica proteina associata alla SLA. I laser a infrarossi creano impulsi di luce, generando frequenze vibrazionali che fungono da identificatore simile a un'impronta digitale. La frequenza identifica in modo univoco e accurato la struttura di una proteina come ripiegata o spiegata.
Sebbene la ricerca non abbia testato l'evidenza dell'aggregazione delle proteine, Serrano ha spiegato che il ripiegamento e l'aggregazione delle proteine sono intimamente legati.
"Si può pensare all'aggregazione come a un evento pieghevole di secondo ordine, " ha detto. "Le proteine spesso si piegano in strutture intermedie lungo la strada verso l'aggregazione. Abbiamo convalidato questa idea che le proteine nella gocciolina non hanno molto spazio e sono costrette a piegarsi:il prossimo passo logico è che sono costrette ad aggregarsi".
Serrano ha affermato che lui e il suo team stanno attualmente conducendo uno studio di follow-up per determinare se un tale evento di ripiegamento possa effettivamente servire come primo passo per il ripiegamento errato in altre proteine.