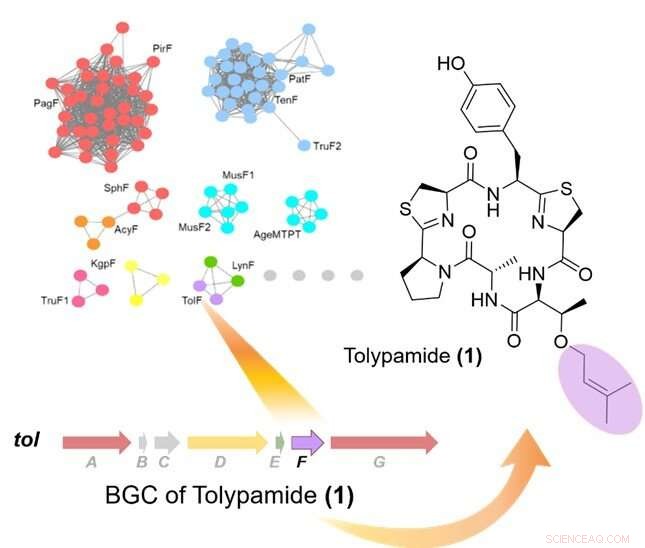
Figura 1:L'estrazione mirata del genoma delle preniltransferasi ha identificato l'enzima TolF e il tol cluster di geni biosintetici (BGC). La parte in alto a sinistra mostra una rete di similarità di sequenza proteica di preniltransferasi. Il cluster di geni biosintetici per la tol viene mostrato il percorso ed è stato collegato alla biosintesi della tolypamide. La tolipamide contiene un residuo di treonina prenilata in avanti (di colore viola). Credito:Università Nazionale di Singapore
I ricercatori di NUS hanno utilizzato un approccio di estrazione del genoma per identificare un nuovo peptide ciclico (tolipamide) derivato da un cianobatterio. La biosintesi della tolypamide presenta un nuovo tipo di enzima in grado di prenilare una serie di substrati e ha un potenziale utilizzo nella chimica farmaceutica e nella biologia sintetica.
I peptidi bioattivi si sono assicurati una roccaforte nel mercato farmaceutico grazie ai numerosi vantaggi come il targeting efficace delle interazioni proteina-proteina, bassi effetti fuori bersaglio, e bassa tossicità. Questi vantaggi sono spesso compromessi a causa della scarsa biodisponibilità e permeabilità cellulare. Un modo per migliorare la permeabilità della membrana è aumentare la lipofilia aggiungendo una catena alchilica alla molecola (prenilazione). Queste trasformazioni, che può essere catalizzata da enzimi coinvolti nella biosintesi dei prodotti naturali di cianobactina, può potenzialmente aumentare l'efficacia terapeutica dei peptidi non modificati. Anche, Gli enzimi cianobactina hanno un'ampia selettività del substrato e agiscono in modo altamente selettivo e specifico per quanto riguarda la posizione e l'orientamento dei residui amminoacidici. Comprendere la logica alla base della selettività e della specificità di questi catalizzatori aiuterà a sfruttare la capacità di questi enzimi come kit di strumenti biochimici.
In collaborazione con un gruppo di ricerca internazionale, Prof Brandon Morinaka del Dipartimento di Farmacia, La National University of Singapore ha scoperto un nuovo tipo di enzima cianobactina noto come ToIF. Presenta selettività specifica per la modifica dei residui di serina e treonina nei peptidi. Questo lavoro è uno sforzo di ricerca congiunto con il Prof. Eric Schmidt dell'Università dello Utah e il Dr. Muriel Gugger dell'Institut Pasteur. Le proteine di una sottofamiglia di preniltransferasi sono state mappate in una rete di similarità di sequenza.
I ricercatori hanno applicato l'estrazione mirata del genoma per analizzare i cluster di geni che codificano per queste proteine e hanno identificato l'enzima ToIF e la via biosintetica del tol. Hanno scoperto che l'enzima TolF è coinvolto nella produzione di tolypamide che ha un gruppo funzionale prenilico idrofobo attaccato alla sua struttura (Figura 1). Tali attacchi molecolari sono utili per migliorare la permeabilità della membrana dei composti terapeutici. L'enzima TolF è stato validato funzionalmente mediante biosintesi in vitro del prodotto naturale di tolypamide (Figura 2). Ulteriori saggi biochimici mostrano che l'enzima TolF è anche in grado di facilitare la prenilazione diretta sui residui di treonina e serina su vari peptidi sintetici.
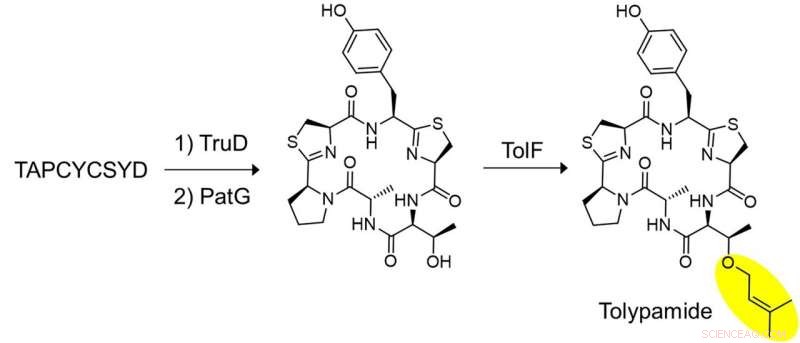
Figura 2:Biosintesi in vitro della tolypamide e validazione funzionale di TolF. È stata condotta una serie di esperimenti chiave per dimostrare che TolF agisce sul peptide ciclico eterociclizzato. Il peptide sintetizzato, TAPCYCSYD è stato incubato sequenzialmente con gli enzimi, TruD (eterociclasi) e PatG (macrociclasi) per fornire il peptide ciclico eterociclizzato. L'incubazione con TolF ha dato una conversione quantitativa al prodotto naturale tolypamide. Credito:Università Nazionale di Singapore
Ad oggi, l'unico altro membro di questa classe di enzimi (preniltransferasi) identificato per agire sui residui di serina o treonina è TruF1. Però, la sua scarsa solubilità e la sua bassa attività in vitro hanno impedito un'ampia caratterizzazione. La scoperta di TolF offre l'opportunità di studiare la biologia strutturale e l'evoluzione di questa famiglia di enzimi.
Il professor Morinaka ha detto, "Un'ulteriore caratterizzazione dell'enzima TolF consentirà una comprensione più completa della specificità del substrato e della selettività delle preniltransferasi. Ciò faciliterà l'ingegneria razionale di questi biocatalizzatori come potenti strumenti nel campo della biologia sintetica".