Astratto grafico. Credito:DOI:10.1038/s41589-021-00841-3
La colecistochinina (CCK) e la gastrina sono i primi ormoni gastrointestinali scoperti. Sono i peptidi più abbondanti nel tratto gastrointestinale e nel sistema nervoso centrale, agendo come ormoni e neurotrasmettitori fisiologicamente importanti attraverso due sottotipi di recettori CCK, CCKAR e CCKBR.
Questi due recettori si impegnano in azioni fisiologiche fondamentali come la regolazione della sazietà, secrezione di enzimi pancreatici, e contrazione della cistifellea. Sono anche implicati nei processi comportamentali, compresa l'ansia, memoria, e tossicodipendenza. Però, lo sviluppo di farmaci contro i recettori della colecistochinina (CCKR) è impegnativo principalmente a causa della mancanza di informazioni strutturali precise.
In due studi entrambi pubblicati in Natura chimica biologia , il gruppo di ricerca guidato da Jiang Yi, Wang Mingwei, H. Eric Xu, Zhao Qiang, e Wu Beili dello Shanghai Institute of Materia Medica dell'Accademia cinese delle scienze e il gruppo di ricerca guidato da Zhao Suwen della ShanghaiTech University, insieme hanno rivelato i meccanismi di riconoscimento del ligando, attivazione e specificità di accoppiamento con proteine G dei CCKR.
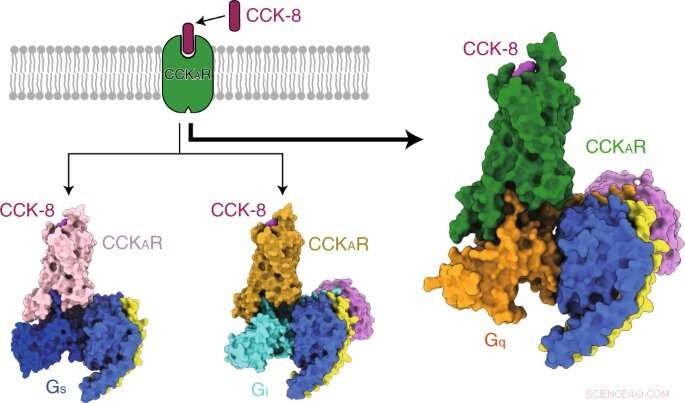
I ricercatori hanno prima risolto tre strutture cristalline del CCKAR umano in un complesso con due antagonisti di piccole molecole (lintitript e devazepide) e un agonista completo NN9056, così come cinque strutture di microscopia crioelettronica (crio-EM) di CCKAR attivato da CCK-8 in complesso con tre proteine G (Gi, Gs, e Gq) e CCKBR attivato dalla gastrina accoppiato a due proteine G (Gi e Gq). Hanno chiarito i meccanismi di riconoscimento dei CCKR da parte dei ligandi, attivazione dei CCKR, e promiscuità della proteina G di CCKAR, tutto ciò fornisce informazioni fondamentali per la scoperta di farmaci di CCKR.
I ricercatori hanno quindi presentato le strutture del CCKAR legato al CCK-8 solfato in complesso con Gq, Gs, e Gi eterotrimeri a risoluzioni globali di 2,9 angstrom, 3.1 angstrom, e 3,2 angstrom, rispettivamente. Hanno scoperto la modalità di legame del peptide endogeno CCK-8, e hanno scoperto che la solfo-tirosina in CCK-8 era cruciale per l'elevata affinità del peptide endogeno per CCKAR.
Costantemente, i ricercatori hanno scoperto che la proteina Gq ha mostrato l'attività di accoppiamento più potente di CCKAR. Questi risultati hanno supportato Gq come trasduttore predominante di CCKAR e hanno evidenziato l'importanza dell'area dell'interfaccia nella selettività dell'accoppiamento della proteina G.
Inoltre, i ricercatori hanno riportato tre strutture cristalline di CCKAR legate a piccoli antagonisti molecolari e un agonista peptidico, così come due strutture crio-EM di complessi CCKBR accoppiati con Gi e Gq. Hanno rivelato la modalità di legame dei CCKR da parte di ligandi sia peptidici che di piccole molecole, e identificato ruoli chiave nel riconoscimento di CCKAR da devazepide e lintitript, fornendo così un modello per la progettazione di farmaci mirati ai CCKR.
Combinando le strutture inattive e attive di CCKAR con l'analisi di simulazione molecolare, i ricercatori hanno proposto il processo di attivazione graduale di CCKAR.
I risultati di questi due studi hanno offerto la prima visione del riconoscimento del ligando e dell'attivazione dei due recettori CCK e hanno fornito una nuova opportunità per la progettazione di farmaci mirati ai CCKR.