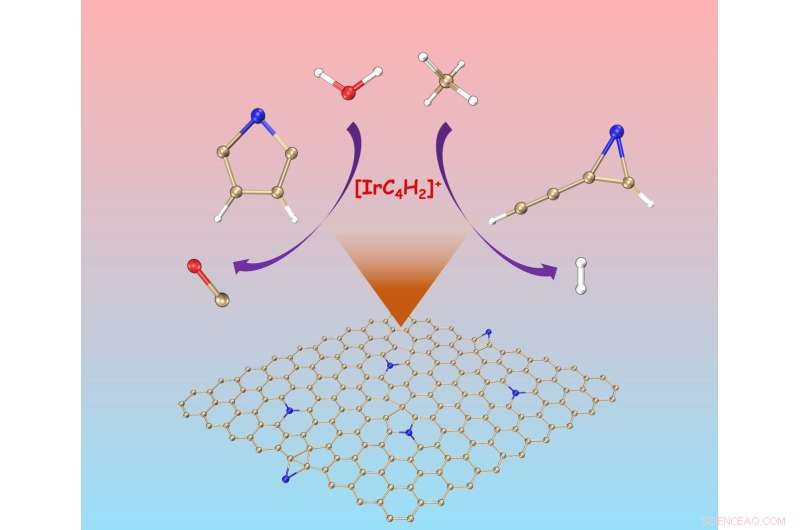
Uno dei due isomeri di [IrC4 H2 ] + attiva solo il metano mentre l'altro è reattivo esclusivamente con l'acqua per produrre CO. Credito:Science China Press
Questo studio è stato condotto dal Prof. Shaodong Zhou (College of Chemical and Biological Engineering, Zhejiang University) e dal Prof. Xiao-Nan Wu (Dipartimento di Chimica, Fudan University). Gli esperimenti sono stati eseguiti utilizzando uno spettrometro di massa a trappola ionica dotato di uno ione di espansione supersonico di vaporizzazione laser combinato con calcoli di chimica quantistica.
È interessante notare che nelle condizioni di impiego due isomeri di [IrC4 H2 ] + coesistono con diverse reattività, una delle quali attiva solo metano mentre l'altra è reattiva esclusivamente con l'acqua per produrre CO. Apparentemente, variando i modelli di coordinazione, il centro Ir acquisisce capacità piuttosto distinte di mediare i processi di rottura e creazione del legame. La reattività verso il metano dipende principalmente dall'orientamento orbitale, mentre l'aromaticità π del complesso di reazione è importante per la conversione dell'acqua.
"A causa della complessa struttura superficiale e della composizione dei catalizzatori, è di grande importanza correlare la struttura elettronica del centro attivo con le sue reattività. Come modello ideale per studiare il meccanismo di reazione a livello strettamente molecolare, la reazione in fase gas può essere eseguito in condizioni che escludono l'interferenza dell'ambiente esterno e, essendo ben ripetibile. Combinato con il calcolo chimico quantistico, può aiutarci a comprendere a fondo il meccanismo di reazione e implementare la progettazione razionale di catalizzatori ad alte prestazioni", afferma Zhou.
Emergono quindi alcune implicazioni per la progettazione di catalizzatori Ir per il reforming del metano con vapore:1) ci si aspetta più lacune di elettroni sulle orbite d (probabilmente indotte dalla polarizzazione locale) per il bene dell'iniziale H3 Attivazione CH; 2) nell'interazione del centro Ir con il CH4 /H2 O molecola, un aumento dell'aromaticità locale sfavorisce un'ulteriore trasformazione, mentre un aumento dell'antiaromaticità locale è indicativo di un'ulteriore attivazione del legame; l'aumento sia dell'aromaticità che dell'anti-aromaticità può essere più evidente per l'acqua.
La ricerca è stata pubblicata su Science China Chemistry . + Esplora ulteriormente