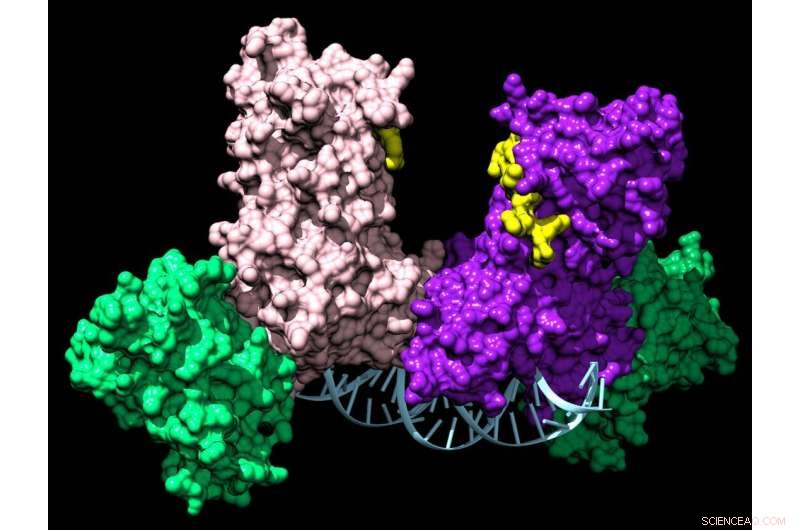
Una coppia di enzimi DNMT3A si unisce a due proteine ausiliarie (verdi) per formare un complesso in quattro parti che viaggia lungo il DNA aggiungendo tag chimici che dicono a una cellula quali geni esprimere. Credito:Jonathan Sandoval et al.
La chemioterapia fa schifo. I trattamenti hanno generalmente terribili effetti collaterali e non è un segreto che i farmaci coinvolti sono spesso tossici per il paziente così come per il cancro. L'idea è che, poiché i tumori crescono così rapidamente, la chemioterapia ucciderà la malattia prima che i suoi effetti collaterali uccidano il paziente. Ecco perché scienziati e medici sono costantemente alla ricerca di terapie più efficaci.
Un team guidato da ricercatori dell'UC Santa Barbara, e che include collaboratori dell'UC San Francisco e del Baylor College of Medicine, ha identificato due composti che sono più potenti e meno tossici delle attuali terapie per la leucemia. Le molecole funzionano in modo diverso rispetto ai trattamenti oncologici standard e potrebbero costituire la base di una classe di farmaci completamente nuova. Inoltre, i composti sono già utilizzati per il trattamento di altre malattie, il che riduce drasticamente la quantità di burocrazia necessaria per adattarli alla leucemia o addirittura prescriverli off-label. I risultati appaiono nel Journal of Medicinal Chemistry .
"Il nostro lavoro su un enzima che è mutato nei pazienti affetti da leucemia ha portato alla scoperta di un modo completamente nuovo di regolare questo enzima, nonché di nuove molecole che sono più efficaci e meno tossiche per le cellule umane", ha affermato il Distinguished Professor dell'UC Santa Barbara Norbert Reich, l'autore corrispondente dello studio.
L'epigenoma
Tutte le cellule del tuo corpo contengono lo stesso DNA, o genoma, ma ognuna usa una parte diversa di questo progetto in base al tipo di cellula. Ciò consente a celle diverse di svolgere le loro funzioni specializzate pur utilizzando lo stesso manuale di istruzioni; essenzialmente, usano solo diverse parti del manuale. L'epigenoma dice alle cellule come usare queste istruzioni. Ad esempio, i marcatori chimici determinano quali parti vengono lette, determinando il vero destino di una cellula.
L'epigenoma di una cellula viene copiato e preservato da un enzima (un tipo di proteina) chiamato DNMT1. Questo enzima garantisce, ad esempio, che una cellula epatica in divisione si trasformi in due cellule epatiche e non in una cellula cerebrale.
Tuttavia, anche negli adulti, alcune cellule hanno bisogno di differenziarsi in diversi tipi di cellule rispetto a prima. Ad esempio, le cellule staminali del midollo osseo sono in grado di formare tutti i diversi tipi di cellule del sangue, che non si riproducono da sole. Questo è controllato da un altro enzima, DNMT3A.
Tutto questo va bene fino a quando qualcosa non va storto con DNMT3A, causando la trasformazione del midollo osseo in globuli anormali. Questo è un evento primario che porta a varie forme di leucemia, così come ad altri tumori.
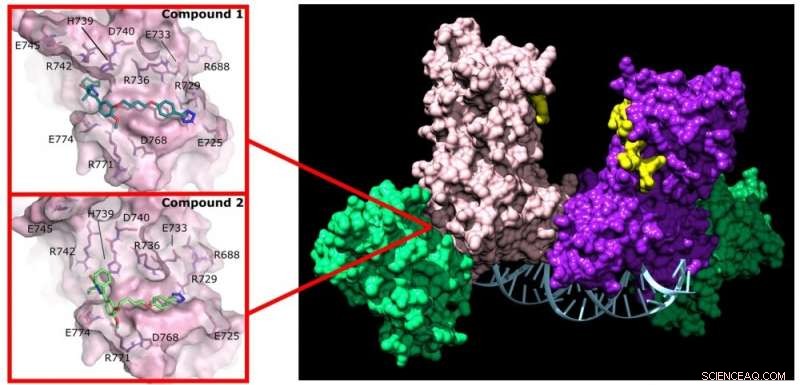
Il pirazolone (composto 1) e la piridazina (composto 2) interrompono l'attività di DNMT3A legandosi a un sito non attivo sull'enzima. Credito:Jonathan Sandoval et al.
Trattamenti tossici
La maggior parte dei farmaci antitumorali sono progettati per uccidere selettivamente le cellule tumorali lasciando sole le cellule sane. Ma questo è estremamente impegnativo, motivo per cui così tanti di loro sono estremamente tossici. Gli attuali trattamenti per la leucemia, come la decitabina, si legano al DNMT3A in un modo che lo disabilita, rallentando così la progressione della malattia. Lo fanno intasando il sito attivo dell'enzima (essenzialmente, la sua parte commerciale) per impedirgli di svolgere la sua funzione.
Sfortunatamente, il sito attivo di DNMT3A è praticamente identico a quello di DNMT1, quindi il farmaco interrompe la regolazione epigenetica in tutti i 30-40 trilioni di cellule del paziente. Questo porta a uno dei più grandi colli di bottiglia dell'industria farmaceutica:la tossicità fuori bersaglio.
L'ostruzione del sito attivo di una proteina è un modo semplice per portarla offline. Ecco perché il sito attivo è spesso il primo posto in cui i designer di farmaci guardano quando progettano nuovi farmaci, ha spiegato Reich. Tuttavia, circa otto anni fa ha deciso di studiare i composti che potrebbero legarsi ad altri siti nel tentativo di evitare effetti fuori bersaglio.
Lavorare insieme
Mentre il gruppo stava indagando su DNMT3A, hanno notato qualcosa di strano. Sebbene la maggior parte di questi enzimi epigenetici funzionino da soli, DNMT3A ha sempre formato complessi, con se stesso o con proteine partner. Questi complessi possono coinvolgere più di 60 partner diversi e, cosa interessante, agiscono come dispositivi di homing per dirigere DNMT3A al controllo di geni particolari.
I primi lavori nel laboratorio del Reich, guidati dall'ex studentessa laureata Celeste Holz-Schietinger, hanno dimostrato che l'interruzione del complesso attraverso mutazioni non interferiva con la sua capacità di aggiungere marcatori chimici al DNA. Tuttavia, il DNMT3A si comportava diversamente quando era da solo o in coppia semplice; non era rimanere sul DNA e marcare un sito dopo l'altro, essenziale per la sua normale funzione cellulare.
Più o meno nello stesso periodo, il New England Journal of Medicine ha fatto un tuffo profondo nelle mutazioni presenti nei pazienti affetti da leucemia. Gli autori di quello studio hanno scoperto che le mutazioni più frequenti nei pazienti con leucemia mieloide acuta sono nel gene DNMT3A. Sorprendentemente, Holz-Schietinger aveva studiato le stesse identiche mutazioni. Il team ora aveva un legame diretto tra DNMT3A e i cambiamenti epigenetici che portano alla leucemia mieloide acuta.
Scoprire un nuovo trattamento
Reich e il suo gruppo si interessarono all'identificazione di farmaci che potevano interferire con la formazione dei complessi DNMT3A che si verificano nelle cellule tumorali. Hanno ottenuto una libreria chimica contenente 1.500 farmaci studiati in precedenza e ne hanno identificati due che interrompono le interazioni di DNMT3A con le proteine partner (inibitori di proteine-proteine o PPI).
Inoltre, questi due farmaci non si legano al sito attivo della proteina, quindi non influenzano il DNMT1 al lavoro in tutte le altre cellule del corpo. "Questa selettività è esattamente ciò che speravo di scoprire con gli studenti di questo progetto", ha detto Reich.
Questi farmaci sono più di una semplice svolta nel trattamento della leucemia. Si tratta di una classe di farmaci completamente nuova:inibitori della proteina-proteina che mirano a una parte dell'enzima lontano dal suo sito attivo. "Un PPI allosterico non è mai stato fatto prima, almeno non per un bersaglio epigenetico di farmaci", ha detto Reich. "Mi ha fatto davvero sorridere quando abbiamo ottenuto il risultato."
Questo risultato non è un'impresa da poco. "Lo sviluppo di piccole molecole che interrompono le interazioni proteina-proteina si è rivelato impegnativo", ha osservato l'autore principale Jonathan Sandoval della UC San Francisco, un ex dottorando nel laboratorio di Reich. "Questi sono i primi inibitori segnalati di DNMT3A che interrompono le interazioni proteina-proteina".
I due composti identificati dal team sono già stati utilizzati clinicamente per altre malattie. Ciò elimina un sacco di costi, test e burocrazia coinvolti nello sviluppo di terapie per la leucemia. In effetti, gli oncologi potrebbero prescrivere questi farmaci a pazienti off label in questo momento.
Costruire sul successo
C'è ancora molto da capire su questo nuovo approccio, però. Il team vuole saperne di più su come gli inibitori delle proteine-proteine influiscono sui complessi DNMT3A nelle cellule sane del midollo osseo. Reich sta collaborando con il professore di chimica della UC Santa Barbara Tom Pettus e un loro dottorando congiunto, Ivan Hernandez. "Stiamo apportando modifiche ai farmaci per vedere se possiamo migliorare ulteriormente la selettività e la potenza", ha affermato Reich.
C'è anche altro da imparare sugli effetti a lungo termine dei farmaci. Poiché i composti agiscono direttamente sugli enzimi, potrebbero non modificare le mutazioni sottostanti che causano il cancro. Questo avvertimento influisce sul modo in cui i medici possono usare questi farmaci. "Un approccio è che un paziente continui a ricevere basse dosi", ha detto Reich. "In alternativa, il nostro approccio potrebbe essere utilizzato con altri trattamenti, forse per ridurre il carico tumorale a un punto in cui interrompere il trattamento è un'opzione".
Reich ammette anche che il team deve ancora imparare quale effetto hanno i PPI sulla differenziazione del midollo osseo a lungo termine. Sono curiosi di sapere se i farmaci possono suscitare qualche tipo di memoria cellulare che potrebbe mitigare i problemi a livello epigenetico o genetico.
Detto questo, Reich è incoraggiato dalla loro scoperta. "Non prendendo di mira il sito attivo di DNMT3A, siamo già molto al di là del farmaco attualmente utilizzato, la decitabina, che è decisamente citotossico", ha affermato, aggiungendo che questo tipo di approccio potrebbe essere adattato anche ad altri tumori. + Esplora ulteriormente