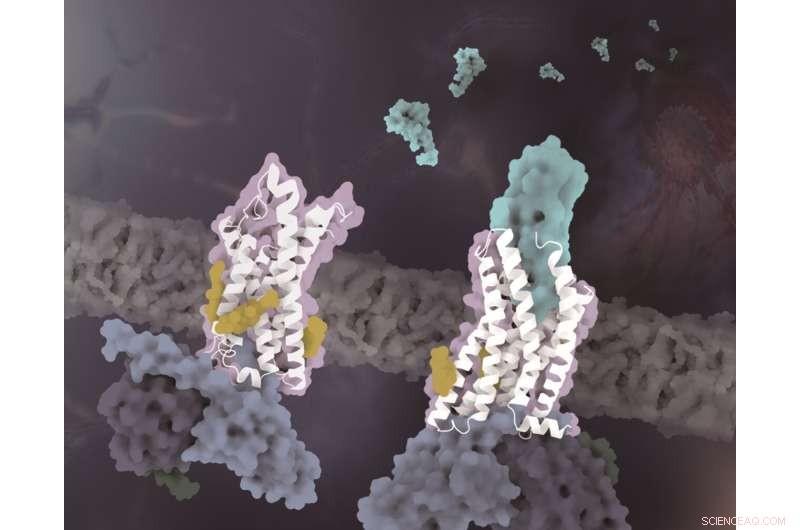
Le strutture di CX3CR1 in stati conformazionali distinti. Il CX3CR1 sia nello stato privo di ligando che nello stato legato al CX3CL1 è colorato di bianco. Il CX3CL1 è di colore ciano, i colesteroli sono colorati di giallo e le tre subunità della proteina G sono colorate rispettivamente di azzurro, blu scuro e verde scuro. Credito:il laboratorio di Zhao Qiang al SIMM
I recettori delle chemochine regolano la migrazione delle cellule immunitarie e sono coinvolti nell'infiammazione, nella costruzione del tumore e nell'infezione da agenti patogeni. Le chemochine sono divise in quattro sottofamiglie in base al numero e alla distribuzione delle cisteine conservate al terminale N:CC, CXC, CX3C e XC.
Le chemochine riconoscono i loro recettori nella stessa sottofamiglia che complicano lo sviluppo di farmaci mirati. Essendo l'unico membro della sottofamiglia dei recettori delle chemochine CX3C, CX3CR1 presenta un vantaggio unico come potenziale bersaglio farmacologico nel trattamento dell'aterosclerosi, del cancro e della neuropatia. Tuttavia, lo sviluppo del farmaco di CX3CR1 è parzialmente ostacolato dalla mancanza di informazioni strutturali che regolano il riconoscimento delle chemochine e l'attivazione dei recettori.
In uno studio pubblicato su Science Advances il 29 giugno, un gruppo di ricerca guidato da Zhao Qiang e Wu Beili dello Shanghai Institute of Materia Medica (SIMM) dell'Accademia cinese delle scienze, ha fatto un passo avanti nel campo dei recettori delle chemochine risolvendo le strutture di microscopia crioelettronica di CX3CR1 -Gi e complessi CX3CR1-CX3CL1-Gi.
Sebbene diverse strutture complesse del recettore delle chemochine nelle sottofamiglie CC e CXC siano state risolte, il meccanismo molecolare del riconoscimento unico di CX3CR1 e CX3CL1 rimane sconosciuto. Con l'analisi delle strutture e dell'allineamento delle sequenze, i ricercatori hanno scoperto che le caratteristiche strutturali uniche del ciclo 30s in CX3CL1 e della regione ECL2 in CX3CR1 svolgono un ruolo chiave nel riconoscimento con il meccanismo di complementarità della forma. Rispetto alle chemochine CC e CXC, il motivo CX3C specifico di CX3CL1 si traduce in uno spostamento maggiore del ciclo degli anni '30 verso il CX3CR1 ECL2.
Poiché l'ECL2 di CX3CR1 contiene meno residui rispetto ad altri recettori delle chemochine, di conseguenza, l'ECL2 più corto nella struttura CX3CR1-CX3CL1 fornisce spazio sufficiente per il ciclo di 30 secondi di CX3CL1. Tuttavia, il ciclo 30s di altre sottofamiglie di chemochine mostra una conformazione non estesa, che è complementare alla superficie dell'ECL2 più lungo dei recettori corrispondenti.
Questa è la prima volta che gli scienziati forniscono le basi strutturali per chiarire il meccanismo molecolare del riconoscimento specifico tra CX3CR1 e il suo ligando endogeno unico.
Oltre alla specificità del riconoscimento del segnale chemiotattico, un altro importante risultato di questo studio rivela che le molecole di colesterolo regolano l'attivazione di CX3CR1. Nelle strutture complesse di entrambi gli stati legati a CX3CL1 e attivati costitutivamente, è stato osservato che tre colesteroli stabilizzano l'elica VI di CX3CR1 con un cambiamento conformazionale molto più piccolo rispetto alle strutture complesse GPCR-Gi di classe A precedentemente risolte. Supportato dai dati funzionali di CX3CR1 e di altri recettori per le chemochine, i colesteroli sono ulteriormente verificati per svolgere ruoli specificamente essenziali nella stabilizzazione della conformazione e nella trasduzione del segnale di CX3CR1.
Questo studio fornisce informazioni sull'esclusivo meccanismo di riconoscimento delle chemochine per la sottofamiglia dei recettori delle chemochine umane. I distinti siti di legame del colesterolo di CX3CR1 approfondiscono le nostre conoscenze sulla modulazione del colesterolo nei GPCR. + Esplora ulteriormente