
Credito:Valerie Altounian
Qualunque cosa tu stia facendo, che si tratti di guidare un'auto, andare a fare jogging o anche quando sei più pigro, mangiare patatine e guardare la TV sul divano, c'è un'intera suite di macchinari molecolari all'interno di ciascuna delle tue cellule al lavoro. Quel macchinario, troppo piccolo per essere visto ad occhio nudo o anche con molti microscopi, crea energia per la cellula, produce le sue proteine, fa copie del suo DNA e molto altro.
Tra quei macchinari, e uno dei più complessi, c'è qualcosa noto come il complesso dei pori nucleari (NPC). L'NPC, che è composto da più di 1.000 singole proteine, è un gatekeeper incredibilmente discriminante per il nucleo della cellula, la regione legata alla membrana all'interno di una cellula che contiene il materiale genetico di quella cellula. Tutto ciò che entra o esce dal nucleo deve passare attraverso l'NPC durante il suo percorso.
Il ruolo dell'NPC come guardiano del nucleo significa che è vitale per le operazioni della cellula. All'interno del nucleo, il DNA, il codice genetico permanente della cellula, viene copiato nell'RNA. Quell'RNA viene quindi estratto dal nucleo in modo che possa essere utilizzato per produrre le proteine di cui la cellula ha bisogno. L'NPC garantisce che il nucleo ottenga i materiali necessari per sintetizzare l'RNA, proteggendo anche il DNA dall'ambiente ostile al di fuori del nucleo e consentendo all'RNA di lasciare il nucleo dopo che è stato creato.
"È un po' come un hangar per aeroplani dove puoi riparare i 747 e la porta si apre per far entrare il 747, ma c'è una persona lì in piedi che può impedire a una sola biglia di uscire mentre le porte sono aperte", afferma André di Caltech Hoelz, professore di chimica e biochimica e docente di facoltà dell'Howard Hughes Medical Institute. Da oltre due decenni Hoelz studia e decifra la struttura dell'NPC in relazione alla sua funzione. Nel corso degli anni, ha costantemente svelato i suoi segreti, svelandoli pezzo dopo pezzo.
Le implicazioni di questa ricerca sono potenzialmente enormi. Non solo l'NPC è centrale per le operazioni della cellula, ma è anche coinvolto in molte malattie. Le mutazioni nell'NPC sono responsabili di alcuni tumori incurabili, di malattie neurodegenerative e autoimmuni come la sclerosi laterale amiotrofica (SLA) e l'encefalopatia necrotizzante acuta e di condizioni cardiache tra cui fibrillazione atriale e morte cardiaca improvvisa precoce. Inoltre, molti virus, incluso quello responsabile del COVID-19, prendono di mira e arrestano l'NPC nel corso del loro ciclo di vita.
Ora, in un paio di articoli pubblicati sulla rivista Scienza , Hoelz e il suo gruppo di ricerca descrivono due importanti scoperte:la determinazione della struttura della faccia esterna dell'NPC e la delucidazione del meccanismo mediante il quale proteine speciali agiscono come una colla molecolare per tenere insieme l'NPC.
Un piccolissimo puzzle 3D
Nel loro articolo intitolato "Architettura della faccia citoplasmatica del poro nucleare", Hoelz e il suo team di ricerca descrivono come hanno mappato la struttura del lato dell'NPC che si affaccia verso l'esterno dal nucleo e nel citoplasma delle cellule. Per fare ciò, hanno dovuto risolvere l'equivalente di un minuscolo puzzle 3D, utilizzando tecniche di imaging come la microscopia elettronica e la cristallografia a raggi X su ogni pezzo del puzzle.
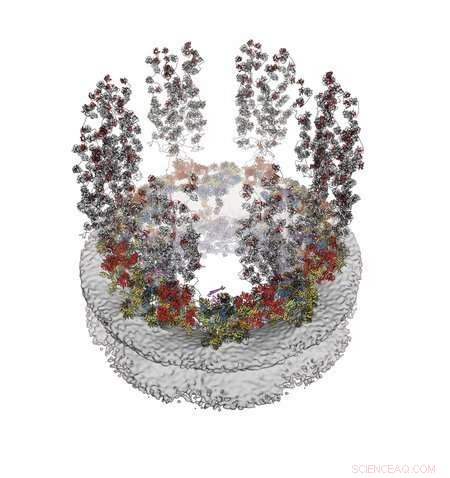
Un modello molecolare della faccia esterna (citoplasmatica) del complesso dei pori nucleari. Ristampato con il permesso di CJ Bley et al., Science 376, eabm9129 (2022). Credito:laboratorio Hoelz/Caltech
Stefan Petrovic, uno studente laureato in biochimica e biofisica molecolare e uno dei primi co-autori degli articoli, afferma che il processo è iniziato con i batteri Escherichia coli (un ceppo di batteri comunemente usati nei laboratori) che sono stati geneticamente modificati per produrre le proteine che compongono l'NPC umano.
"Se entri nel laboratorio, puoi vedere questo gigantesco muro di flaconi in cui crescono le culture", dice Petrovic. "Esprimiamo ogni singola proteina nelle cellule di E. coli, rompiamo quelle cellule e purifichiamo chimicamente ogni componente proteico".
Una volta completata la purificazione, che può richiedere fino a 1.500 litri di coltura batterica per ottenere materiale sufficiente per un singolo esperimento, il team di ricerca ha iniziato a testare scrupolosamente come i pezzi dell'NPC si incastrano tra loro.
George Mobbs, un ricercatore post-dottorato senior associato in chimica e un altro co-primo autore dell'articolo, afferma che l'assemblea è avvenuta in modo "graduale"; invece di versare tutte le proteine insieme in una provetta allo stesso tempo, i ricercatori hanno testato coppie di proteine per vedere quali si sarebbero adattati insieme, come due pezzi di un puzzle. Se fosse stata trovata una coppia che si adattava insieme, i ricercatori avrebbero quindi testato le due proteine ora combinate rispetto a una terza proteina fino a quando non ne avessero trovata una che si adattasse a quella coppia, quindi la struttura a tre pezzi risultante sarebbe stata testata contro altre proteine, e così Su. Lavorando attraverso le proteine in questo modo si ottiene il risultato finale della loro carta:un cuneo di 16 proteine che viene ripetuto otto volte, come fette di pizza, per formare la faccia dell'NPC.
"Abbiamo riportato la prima struttura completa dell'intera faccia citoplasmatica dell'NPC umano, insieme a una rigorosa convalida, invece di riportare una serie di progressi incrementali di frammenti o porzioni basati su osservazioni parziali, incomplete o a bassa risoluzione", afferma Si Nie , ricercatore post-dottorato associato in chimica e anche co-primo autore dell'articolo. "Abbiamo deciso di attendere pazientemente fino a quando non avessimo acquisito tutti i dati necessari, riportando una quantità enorme di nuove informazioni."
Il loro lavoro ha integrato la ricerca condotta da Martin Beck del Max Planck Institute of Biophysics di Francoforte, in Germania, il cui team ha utilizzato la tomografia crioelettronica per generare una mappa che fornisse i contorni di un puzzle in cui i ricercatori hanno dovuto posizionare i pezzi. Per accelerare il completamento del puzzle della struttura dell'NPC umano, Hoelz e Beck si sono scambiati dati più di due anni fa e poi hanno costruito strutture indipendenti dell'intero NPC. "La mappa Beck sostanzialmente migliorata mostrava molto più chiaramente dove doveva essere posizionato ogni pezzo dell'NPC, per il quale abbiamo determinato le strutture atomiche, simile a una cornice di legno che definisce il bordo di un puzzle", afferma Hoelz.
Le strutture determinate sperimentalmente dei pezzi NPC del gruppo Hoelz sono servite a convalidare la modellazione del gruppo Beck. "Abbiamo posizionato le strutture nella mappa in modo indipendente, utilizzando approcci diversi, ma i risultati finali erano completamente d'accordo. È stato molto soddisfacente vederlo", afferma Petrovic.
"Abbiamo costruito una struttura su cui ora è possibile fare molti esperimenti", afferma Christopher Bley, ricercatore post-dottorato senior associato in chimica e anche co-primo autore. "Ora abbiamo questa struttura composita e consente e informa futuri esperimenti sulla funzione degli NPC, o persino sulle malattie. Ci sono molte mutazioni nell'NPC associate a malattie terribili e sapere dove si trovano nella struttura e come insieme possono aiutare a progettare la prossima serie di esperimenti per cercare di rispondere alle domande su cosa stanno facendo queste mutazioni."
'Questa elegante composizione di spaghettini'
Nell'altro documento, intitolato "Architecture of the linker-scaffold in the nuclear pore", il team di ricerca descrive come ha determinato l'intera struttura di ciò che è noto come linker-scaffold dell'NPC, la raccolta di proteine che aiutano a tenere insieme l'NPC fornendo allo stesso tempo la flessibilità di cui ha bisogno per aprirsi e chiudersi e per adattarsi alle molecole che lo attraversano.
Hoelz paragona l'NPC a qualcosa costruito con mattoncini Lego che si incastrano senza incastrarsi e sono invece legati insieme da elastici che li tengono per lo più in posizione pur consentendo loro di muoversi un po'.
"Io chiamo questi pezzi di colla non strutturati la 'materia oscura dei pori'", dice Hoelz. "Questa elegante disposizione di spaghetti tiene tutto insieme."
Il processo per caratterizzare la struttura del linker-scaffold era più o meno lo stesso del processo utilizzato per caratterizzare le altre parti dell'NPC. Il team ha prodotto e purificato grandi quantità di molti tipi di proteine linker e scaffold, ha utilizzato una varietà di esperimenti biochimici e tecniche di imaging per esaminare le interazioni individuali e le ha testate pezzo per pezzo per vedere come si adattano insieme nell'NPC intatto.
Per verificare il loro lavoro, hanno introdotto mutazioni nei geni che codificano per ciascuna di quelle proteine linker in una cellula vivente. Poiché sapevano come quelle mutazioni avrebbero cambiato le proprietà chimiche e la forma di una specifica proteina linker, rendendola difettosa, potevano prevedere cosa sarebbe successo alla struttura degli NPC della cellula quando quelle proteine difettose fossero state introdotte. Se gli NPC della cellula erano funzionalmente e strutturalmente difettosi nel modo previsto, sapevano di avere la corretta disposizione delle proteine linker.
"Una cellula è molto più complicata del semplice sistema che creiamo in una provetta, quindi è necessario verificare che i risultati ottenuti dagli esperimenti in vitro reggano in vivo", afferma Petrovic.
L'assemblaggio della faccia esterna dell'NPC ha anche contribuito a risolvere un mistero di lunga data sull'involucro nucleare, il sistema a doppia membrana che circonda il nucleo. Come la membrana della cellula all'interno della quale risiede il nucleo, la membrana nucleare non è perfettamente liscia. Piuttosto, è costellato di molecole chiamate proteine integrali di membrana (IMP) che svolgono una varietà di ruoli, tra cui agire come recettori e aiutare a catalizzare reazioni biochimiche.
Sebbene gli IMP possano essere trovati sia sul lato interno che su quello esterno dell'involucro nucleare, non era chiaro come viaggiassero effettivamente da un lato all'altro. Infatti, poiché gli IMP sono bloccati all'interno della membrana, non possono semplicemente scivolare attraverso il canale di trasporto centrale dell'NPC come fanno le molecole fluttuanti.
Una volta che il team di Hoelz ha compreso la struttura dell'impalcatura di collegamento dell'NPC, si è reso conto che consente la formazione di piccole "grondaie" attorno al suo bordo esterno che consentono agli IMP di scivolare oltre l'NPC da un lato all'altro dell'involucro nucleare mentre rimanendo sempre incastonato nella membrana stessa.
"Spiega molte cose che sono state enigmatiche sul campo. Sono molto felice di vedere che il canale di trasporto centrale ha davvero la capacità di dilatarsi e formare porte laterali per questi IMP, come avevamo originariamente proposto più di un decennio fa ", dice Hoelz.
Nel loro insieme, i risultati dei due articoli rappresentano un balzo in avanti nella comprensione da parte degli scienziati di come è costruito l'NPC umano e di come funziona. Le scoperte del team aprono le porte a molte più ricerche. "Dopo aver determinato la sua struttura, ora possiamo concentrarci sull'elaborazione delle basi molecolari per le funzioni dell'NPC, come il modo in cui l'mRNA viene esportato e le cause alla base delle molte malattie associate agli NPC, con l'obiettivo di sviluppare nuove terapie", afferma Hoelz.
I documenti che descrivono il lavoro compaiono nel numero del 10 giugno della rivista Scienza . + Esplora ulteriormente