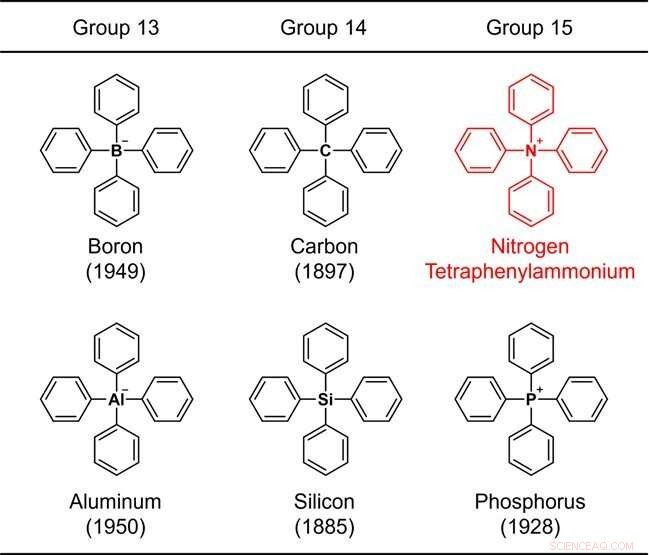
Figura 1. Strutture di elementi tetrafenil-sostituiti appartenenti ai gruppi 13–15. Il numero tra parentesi indica l'anno di sintesi. Credito:Università di Kanazawa
tetrafenilammonio, con tutti e quattro gli idrogeni dell'ammonio (NH4 + ) sostituito con anelli benzenici, non è stato né scoperto in natura né sintetizzato chimicamente, mettendo in dubbio la sua esistenza. Qui siamo riusciti a sintetizzare per la prima volta il tetrafenilammonio, dimostrando la sua esistenza stabile. La strategia sintetica utilizzata in questo studio, l'accoppiamento radicale, può essere applicabile alla sintesi di vari ammoni correlati con un'elevata novità strutturale. Lo studio è pubblicato su Nature Communications .
Poiché l'anello benzenico è un costituente rappresentativo dei composti organici, una struttura costituita solo da un elemento comune più l'anello benzenico è considerata uno degli scheletri chimici più fondamentali. A causa della loro importanza, la sintesi chimica di tali molecole è stata studiata sin dai primi giorni della chimica organica. Ad esempio, la struttura in cui quattro anelli benzenici sono legati a un elemento rappresentativo (boro, carbonio, alluminio, silicio o fosforo) dei gruppi da 13 a 15 nella tavola periodica (Fig. 1) è stata sintetizzata più di 70 anni fa, e il più antico rapporto sintetico risale a 137 anni fa.
Questi scheletri sono indicati collettivamente come "tetrafenile", il che significa che la struttura contiene 4 anelli benzenici. Quando l'elemento centrale è azoto, ammonio, NH4 + , è considerato lo ione genitore. Tale composto è chiamato tetrafenilammonio. Questo composto, in effetti uno ione, ha una struttura chimica molto semplice che anche un principiante in chimica organica può facilmente immaginare.
Tuttavia, si è rivelato molto difficile creare artificialmente questa struttura e non sono stati pubblicati rapporti sintetici con una chiara identificazione della struttura. Inoltre, poiché non è stato scoperto in natura, non è stato finora chiaro se il tetrafenilammonio possa esistere. Sono apparse pubblicazioni che ne presuppongono l'esistenza e ne menzionano solo l'uso senza descriverne la sintesi o il metodo di acquisizione. I database composti contengono solo la struttura chimica. Quindi questo ione viene talvolta indicato come se fosse già noto. Tuttavia, in realtà, nessuno l'ha effettivamente osservato, rendendo il tetrafenilammonio uno "ione fantasma".
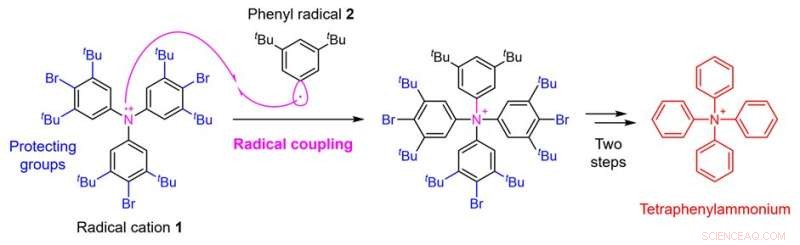
Figura 2. Strategia di sintesi del tetrafenilammonio utilizzando l'accoppiamento radicalico. Credito:Università di Kanazawa
In questo studio, un gruppo di ricerca presso la Facoltà di Scienze Farmaceutiche dell'Università di Kanazawa ha consentito la sintesi del tetrafenilammonio stabilendo una nuova strategia sintetica. Il punto critico nella sintesi del tetrafenilammonio è l'aggiunta del quarto gruppo fenilico all'atomo di azoto che ha già tre gruppi fenilici attaccati. Si pensava che fosse difficile ottenere questa sintesi con le tecniche convenzionali. Nel presente studio, quindi, il gruppo di ricerca ha applicato una tecnica chiamata accoppiamento radicalico e ha utilizzato una strategia per far reagire il catione radicale 1 preparato da un derivato della trifenilammina con il radicale fenile 2 (Fig. 2).
Di conseguenza, sebbene la resa fosse inferiore allo 0,1%, il team di ricerca è riuscito a eseguire la conversione chimica desiderata. In tali accoppiamenti radicalici, i radicali altamente reattivi formano legami tra loro, il che ha il vantaggio di consentire la formazione di legami che non potrebbero essere raggiunti con altri metodi. D'altra parte, ha lo svantaggio che è difficile controllare la selettività perché la reattività è troppo alta, portando a varie reazioni collaterali.
Pertanto, in questa sintesi, al fine di sopprimere il più possibile la reazione laterale di formazione di legami sul carbonio del catione radicale 1, il team di ricerca ha anche ideato l'introduzione di gruppi protettivi) che causano l'impedimento sterico. Infine, sono state effettuate un totale di cinque fasi di conversione chimica di un noto derivato della trifenilammina, materiale di partenza per la sintesi, mediante l'introduzione dei gruppi protettivi, l'accoppiamento radicalico e la successiva rimozione dei gruppi protettivi, portando al tetrafenilammonio.

Figura 3. Struttura cristallina a raggi X del tetrafenilammonio. Credito:Università di Kanazawa
Sulla base dei dati ottenuti da varie analisi strumentali, è stata confermata la struttura del tetrafenilammonio. cristallografia a raggi X) ha rivelato che la lunghezza del legame tra l'atomo di azoto e l'atomo di carbonio del gruppo fenile contenuto in questo ione è solo 1,529 Å (Fig. 3).
Poiché questa lunghezza di legame è inferiore a quella di una struttura tetrafenile contenente un altro elemento (boro, carbonio, alluminio, silicio o fosforo), è evidente che l'atomo di azoto del tetrafenilammonio si trova in un ambiente più spazialmente ostacolato rispetto ad altri elementi. Questo ostacolo tridimensionale è considerato uno dei fattori che rendono difficile la costruzione di questo scheletro. Inoltre, i nostri risultati hanno anche rivelato che il tetrafenilammonio ha un'elevata stabilità per resistere a condizioni fortemente acide e basiche.
Il presente studio ha dimostrato che il tetrafenilammonio esiste effettivamente e può essere sintetizzato chimicamente. Se in futuro verrà realizzata la sintesi su larga scala di questo ione e dei suoi derivati, potrebbe essere potenzialmente applicato in vari campi di ricerca come catione organico con elevata stabilità chimica. Inoltre, la strategia di accoppiamento radicale utilizzata in questo studio può essere applicabile alla sintesi di altri ammoni correlati che non è stato possibile realizzare finora. + Esplora ulteriormente