L'atomo è l'unità più elementare di qualsiasi elemento che mantiene ancora le proprietà di quell'elemento. Poiché gli atomi sono troppo piccoli per essere visti, la loro struttura è sempre stata qualcosa di misterioso. Per migliaia di anni, filosofi e scienziati hanno proposto teorie sulla composizione di questa misteriosa particella, con gradi sempre più sofisticati. Sebbene esistessero molti modelli, quattro principali hanno portato al nostro attuale concetto di atomo.
Il modello di budino di prugne
Il cosiddetto modello di budino di prugne è stato proposto dallo scienziato J.J. Thomson nel 1904. Questo modello fu concepito dopo la scoperta dell'elettrone da parte di Thomson come una particella discreta, ma prima si comprese che l'atomo aveva un nucleo centrale. In questo modello, l'atomo è una sfera di carica positiva - il budino - in cui si trovano gli elettroni - le prugne. Gli elettroni ruotano in percorsi circolari definiti all'interno del blob positivo che costituisce la maggior parte dell'atomo.
Modello planetario
Questa teoria è stata proposta dal chimico vincitore del premio Nobel Ernest Rutherford nel 1911 ed è talvolta chiamata la Modello Rutherford. Sulla base di esperimenti che mostrarono che l'atomo sembrava contenere un piccolo nucleo di carica positiva, Rutherford postulò che l'atomo era costituito da un piccolo nucleo denso e carico positivamente, attorno al quale gli elettroni orbitavano in anelli circolari. Questo modello è stato uno dei primi a proporre la strana idea che gli atomi siano per lo più costituiti da spazio vuoto attraverso il quale si muovono gli elettroni.
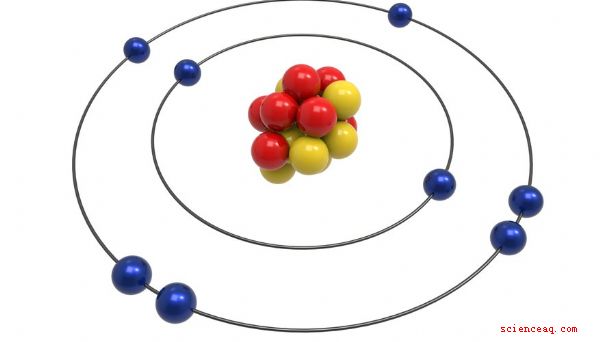
Modello di Bohr
Il modello di Bohr è stato ideato da Neils Bohr, un fisico di Danimarca, che ha ricevuto il premio Nobel per il suo lavoro sull'atomo. In un certo senso è un miglioramento più sofisticato del modello di Rutherford. Bohr propose, come Rutherford, che l'atomo avesse un piccolo nucleo positivo in cui risiedeva la maggior parte della sua massa. Dichiarò che gli elettroni orbitavano attorno a questo nucleo come pianeti attorno al sole. Il principale miglioramento del modello di Bohr era che gli elettroni erano limitati a impostare orbite attorno al nucleo, ciascuno con un livello di energia specifico, il che spiegava osservazioni sperimentali come la radiazione elettromagnetica.
Modello di nuvola di elettroni
La nuvola di elettroni Il modello è attualmente il modello più sofisticato e ampiamente accettato dell'atomo. Mantiene il concetto del nucleo dai modelli di Bohr e Rutherford, ma introduce una diversa definizione del moto degli elettroni attorno al nucleo. Il movimento di elettroni attorno al nucleo in questo modello è definito da regioni in cui vi è una maggiore probabilità di trovare l'elettrone in un dato momento. Queste regioni di probabilità attorno al nucleo sono associate a livelli di energia specifici e assumono una varietà di forme dispari man mano che l'energia degli elettroni aumenta.