Il patogeno batterico opportunista Pseudomonas aeruginosa è pericoloso a causa della sua resistenza a molteplici antibiotici. Un gruppo di ricerca dell'Università Heinrich Heine di Düsseldorf (HHU) e del Centro di ricerca Jülich (Forschungszentrum Jülich—FZJ) ha ora trovato un meccanismo che consente di indebolire la virulenza dell'agente patogeno.
Sulla base di queste conoscenze, è possibile sviluppare un nuovo approccio per gli antibiotici, come spiegano gli autori in JACS Au . La redazione della rivista ha dedicato una cover story a questa scoperta.
Il batterio Pseudomonas aeruginosa provoca spesso nell'uomo la cosiddetta "infezione nosocomiale". È quindi uno dei pericolosi batteri ospedalieri resistente a diversi antibiotici. I pazienti immunocompromessi sono particolarmente colpiti. L'Organizzazione Mondiale della Sanità (OMS) ha inserito P. aeruginosa nell'elenco dei "patogeni prioritari" su cui dovrebbero concentrarsi gli sforzi di ricerca per trovare nuove opzioni terapeutiche.
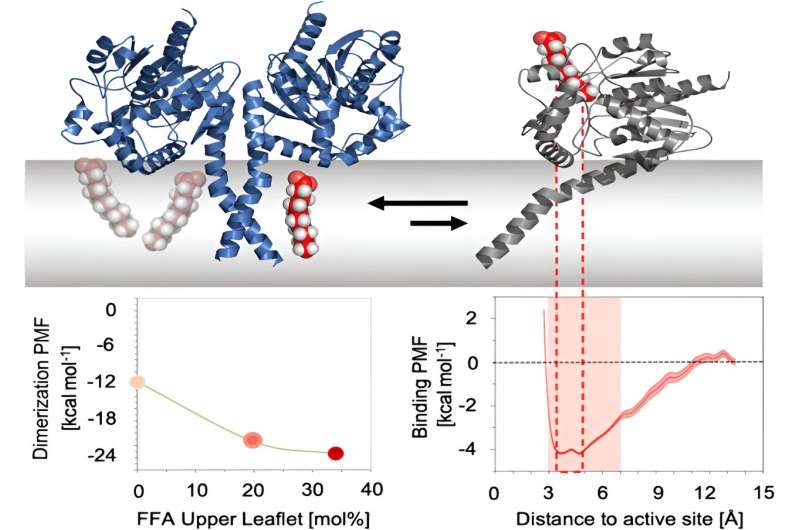
Il batterio ha un ampio spettro di fattori di virulenza che causano malattie. Tra questi figurano le "fosfolipasi di tipo A" (PLA1):enzimi che possono danneggiare la membrana della cellula ospite e interrompere anche diverse reti di segnalazione nelle cellule infette. Il lavoro preliminare ha dimostrato che l'enzima PlaF di P. aeruginosa è un PLA1 che altera anche il profilo della membrana e contribuisce quindi alla virulenza del batterio.
I gruppi di ricerca del Professor Dr. Holger Gohlke (Istituto HHU di chimica farmaceutica e medicinale e IBG-4:Bioinformatica presso FZJ) e del Professor Dr. Karl-Erich Jaeger (Istituto HHU di tecnologia degli enzimi molecolari presso FZJ) hanno ora identificato i meccanismi molecolari in quali acidi grassi liberi a catena media regolano l'attività del PlaF.
I ricercatori hanno effettuato simulazioni molecolari, studi di laboratorio e test in vivo. Tutti questi approcci di ricerca hanno mostrato un effetto indiretto degli acidi grassi sulla posizione del PlaF nella membrana batterica, nonché un effetto diretto bloccando il centro attivo dell'enzima. In entrambi i modi, l'attività di PlaF è ridotta.
Da un lato, i risultati forniscono la prova che l’interazione dei meccanismi è un fattore regolatore per la funzione PlaF. Professor Gohlke:"Siamo riusciti a svelare queste complesse relazioni solo attraverso l'interazione di tecniche assistite da computer e sperimentali nell'ambito dei progetti finanziati dal CRC 1208."
D’altra parte, i risultati contribuiscono a comprendere il ruolo regolatore degli acidi grassi. Potrebbe essere possibile trasferire i risultati ad altre proteine di membrana che hanno una struttura simile a PlaF.
Infine, aprono anche nuove prospettive su come il PlaF possa essere inibito. Professor Jaeger:"Si tratta di un approccio promettente per lo sviluppo di nuovi antibiotici contro P. aeruginosa. Questi sono urgentemente necessari per combattere i pericolosi agenti patogeni negli ospedali."
Ulteriori informazioni: Rocco Gentile et al, Meccanismi molecolari alla base dell'attività regolata dagli acidi grassi liberi a catena media della fosfolipasi PlaF di Pseudomonas aeruginosa, JACS Au (2024). DOI:10.1021/jacsau.3c00725
Informazioni sul giornale: JACS Au
Fornito dall'Università Heinrich-Heine di Duesseldorf