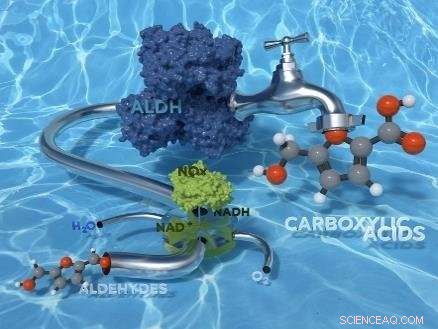
Immagine di copertina dell'attuale edizione di Green Chemistry con la ricerca HIMS/Biocat.
I ricercatori dell'Istituto Van't Hoff per le scienze molecolari (HIMS) dell'Università di Amsterdam hanno sviluppato il primo processo biocatalitico "verde" praticabile per l'ossidazione chemioselettiva delle aldeidi in acidi carbossilici. L'articolo che descrive la ricerca appare nell'attuale edizione della rivista chimica verde .
L'ossidazione delle aldeidi ad acidi carbossilici è una reazione chimica importante e rilevante a livello industriale, ad esempio per quanto riguarda la sintesi di prodotti farmaceutici e polimeri a base biologica. Le attuali procedure di ossidazione richiedono l'uso abbondante di reagenti chimici tossici e spesso producono prodotti collaterali indesiderati.
Alla ricerca di un miglioramento dell'impronta ambientale per l'ossidazione degli aldeidi, sono stati studiati vari nuovi metodi sintetici. Fino ad ora, però, non è stata sviluppata alcuna procedura economicamente valida basata su reagenti e/o solventi rispettosi dell'ambiente, e che combina un'elevata produttività con una perfetta selettività (nel senso che vengono ossidati solo i gruppi funzionali aldeidici desiderati, minimizzando o addirittura evitando completamente la formazione di prodotti collaterali indesiderati).
Biocatalisi benigna
Come un'interessante alternativa "verde", biocatalitico, i metodi basati su enzimi per l'ossidazione dei gruppi funzionali mostrano condizioni di reazione blande (temperatura ambiente e pressione atmosferica) in un ambiente acquoso, e generalmente ottengono selettività molto buone. Per di più, possono utilizzare l'ossigeno molecolare come ossidante benigno.
Il team di ricerca HIMS guidato dal DrFrancesco Mutti ha ora esplorato con successo l'uso degli enzimi aldeide deidrogenasi per l'ossidazione delle aldeidi ad acidi carbossilici. In un articolo recentemente accettato dalla rivista ad alto impatto RSC chimica verde , i ricercatori presentano uno studio su tre aldeide deidrogenasi ricombinanti provenienti da lenti bovine e dai batteri Escherichia coli e Pseudomonas putida. Per la rigenerazione del coenzima catalitico NAD+, hanno applicato l'H 2 O formando NAD-ossidasi da Streptococcus mutans. La bioossidazione finale avviene in tampone fosfato acquoso, in condizioni di reazione blande (40 °C e pressione atmosferica) e consuma solo diossigeno dall'aria come ossidante.
Ampio studio
Per studiare il potenziale dei tre enzimi, i ricercatori hanno eseguito un ampio studio in cui hanno testato sessantuno aldeidi strutturalmente diverse. La maggior parte di questi substrati (alifatici, aril alifatico, benzilico-, aldeidi eteroaromatiche e bicicliche) sono state convertite con rese ben superiori al 60% e in molti casi anche superiori al 99%. Le uniche eccezioni erano alcune benzaldeidi orto-sostituite e due aldeidi eteroaromatiche bicicliche.
In tutti i casi, la chemioselettività era perfetta:nessun altro prodotto è stato rilevato se non l'acido carbossilico atteso. Ciò significa che altre funzionalità ossidabili (come la parte ossidrile, gruppi alchenici, gruppi arilici, e gli eteroatomi di zolfo e di azoto) sono rimasti intatti.
cellule intere
Poiché per le applicazioni pratiche è da preferire l'uso di cellule intere piuttosto che di enzimi purificati, evitando lunghe e costose fasi di purificazione, i ricercatori hanno anche studiato la bio-ossidazione conE. coli cellule intere liofilizzate e cellule a riposo. Si è scoperto che l'integrazione di NAD+coenzima e dell'enzima di riciclo di NOx può essere omessa in alcuni casi poiché l'ospite microbico produce una quantità sufficiente di coenzima, che può essere riciclato da enzimi endogeni di E. coli.
I ricercatori concludono che le aldeidi deidrogenasi hanno il potenziale per diventare la prima scelta per l'ossidazione chemioselettiva delle aldeidi in gruppi carbossilici. Il loro metodo biocatalitico è particolarmente interessante per l'ossidazione di porzioni aldeidici all'interno di molecole che possiedono ulteriori gruppi ossidabili. La ricerca futura si concentrerà sul miglioramento della tolleranza degli enzimi alla concentrazione del substrato e alla stabilità a lungo termine al fine di consentire un'applicazione ancora più ampia di questi enzimi.