Il Paclitaxel è il farmaco antitumorale di origine vegetale più venduto al mondo e uno dei farmaci antitumorali più efficaci negli ultimi 30 anni. È ampiamente utilizzato nel trattamento di vari tipi di cancro, tra cui il cancro al seno, il cancro ai polmoni e il cancro alle ovaie.
Alla fine degli anni '90 e all'inizio del 21° secolo, le vendite annuali di paclitaxel hanno superato 1,5 miliardi di dollari e hanno raggiunto i 2,0 miliardi di dollari nel 2001, diventando così il farmaco più venduto nel 2001. Nel 2019, il mercato del paclitaxel e dei suoi derivati era di circa 15 miliardi di dollari, e si prevede che raggiungerà i 20 miliardi di dollari entro il 2025.
Essendo un farmaco antitumorale, la struttura molecolare del paclitaxel è estremamente complessa, con intricati anelli a ponte altamente ossidati e 11 stereocentri, che lo rendono ampiamente riconosciuto come uno dei prodotti naturali più difficili da sintetizzare chimicamente. Da quando i gruppi di ricerca Holton e Nicolaou hanno segnalato la prima sintesi totale di paclitaxel nel 1994, più di 40 gruppi di ricerca sono stati impegnati nella sintesi totale di paclitaxel.
Tuttavia, anche nel percorso di sintesi chimica più breve fino ad oggi, la resa complessiva di paclitaxel è solo dello 0,118%, il che non riesce a soddisfare la domanda di produzione industriale. Attualmente, la produzione industriale di paclitaxel impiega una strategia semi-sintetica:isolando i precursori del paclitaxel (come la baccatina III) da colture di cellule vegetali o foglie di Taxus e quindi convertendoli in paclitaxel attraverso metodi chimici. Tuttavia, la strategia semi-sintetica fa molto affidamento sulle risorse naturali ed è limitata dalla lenta crescita delle cellule o delle foglie del Taxus, e quindi non può soddisfare la crescente domanda del mercato.
Con il rapido sviluppo della biotecnologia, le strategie di biologia sintetica per la biosintesi microbica dei prodotti naturali vegetali sono emerse come un potente approccio per produrre in modo efficiente prodotti naturali vegetali complessi.
Pertanto, il raggiungimento di una produzione efficiente, rispettosa dell’ambiente e sostenibile di paclitaxel attraverso la biologia sintetica ha attirato un’attenzione diffusa. Tuttavia, per realizzare la sintesi de novo del paclitaxel in un sistema eterologo è necessario identificare gli enzimi chiave mancanti nel percorso biosintetico del paclitaxel e stabilire un percorso biosintetico completo per il paclitaxel.
Per affrontare la sfida di lunga data della biosintesi del paclitaxel nei Taxus, due gruppi di ricerca guidati dal Prof. Jianbin Yan (Istituto di genomica agricola di Shenzhen, AGIS) e dal Prof. Xiaoguang Lei (Università di Pechino, PKU), nonché altri gruppi di ricerca di altre cinque diverse istituzioni, tra cui l'Università di Tsinghua e l'UCLA, hanno collaborato insieme per identificare con successo gli enzimi mancanti e ottenere la ricostituzione degli enzimi biosintetici che portano alla baccatina III.
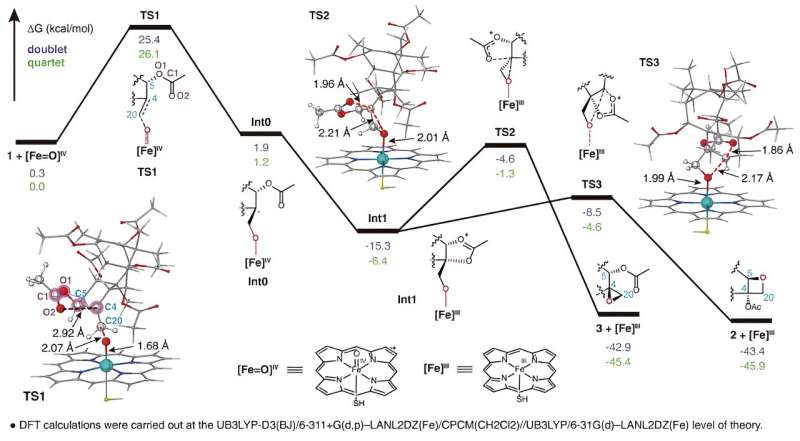
I ricercatori hanno utilizzato un sistema di espressione eterologa del tabacco per eseguire lo screening dell'attività della famiglia di geni CYP725A riscontrata specificamente nel Taxus tramite una strategia di co-iniezione del substrato. Hanno identificato con successo un enzima biosintetico denominato Taxane oxetanasi (TOT) che catalizza la formazione dell'anello ossetano durante il percorso di biosintesi del tassolo.
TOT catalizza la formazione dell'anello ossetano unico attraverso l'ossidazione del doppio legame C4,20 e il successivo riarrangiamento del gruppo acetile adiacente nella posizione C5, come illustrato in. Questo nuovo meccanismo di reazione della formazione dell'anello ossetano rompe la comprensione convenzionale secondo cui l'anello ossetano la formazione nella via della biosintesi del tassolo si ottiene attraverso una reazione di riarrangiamento dell'epossido corrispondente.
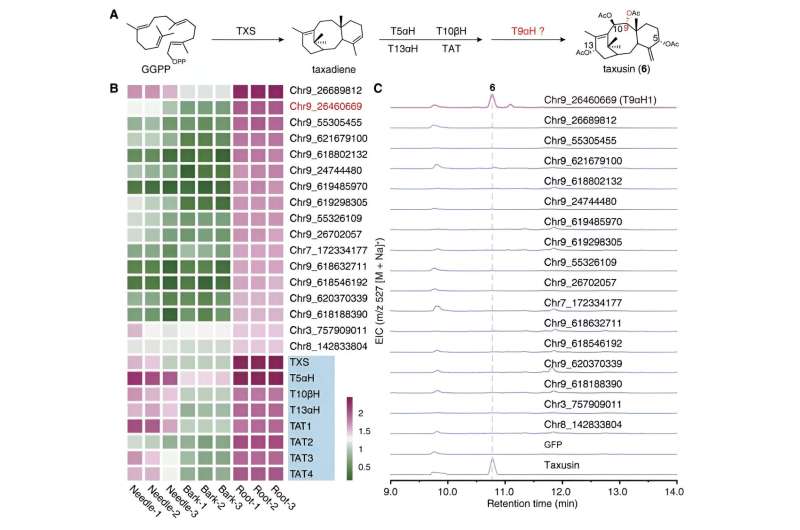
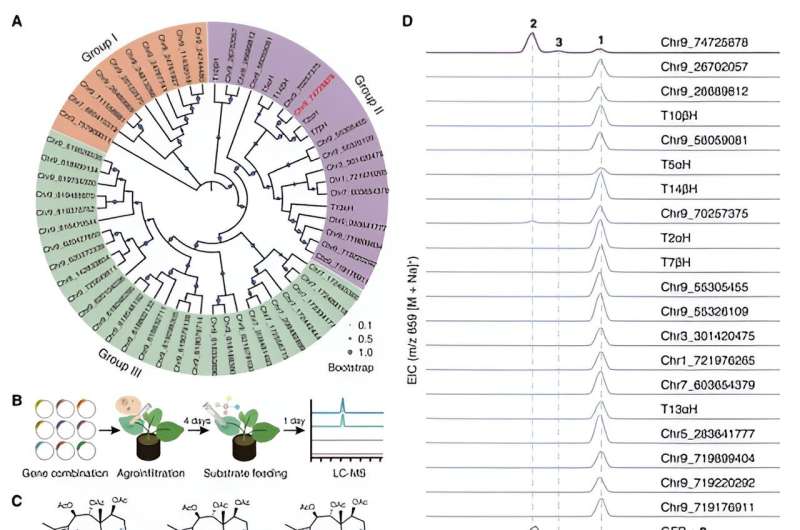
Nel frattempo, concentrandosi sul composto strutturalmente più semplice, la taxusina, i ricercatori hanno identificato 17 geni candidati che codificano per enzimi responsabili dell'ossidazione C9 dei taxani utilizzando l'analisi di coespressione e l'analisi del metabolismo. Questi geni candidati sono stati ulteriormente sottoposti a screening dell'attività ricostruendo la via biosintetica della taxusina nel tabacco, portando alla scoperta dell'enzima responsabile dell'ossidazione del C9 nei taxani, chiamato Taxano 9α idrossilasi (T9αH).
Con questi due enzimi recentemente identificati TOT e T9αH in mano, i ricercatori hanno cercato di ottenere la biosintesi totale della baccatina III nel tabacco co-esprimendoli con altri geni biosintetici noti del tassolo. Hanno rilevato con successo la produzione di baccatina III nel tabacco quando TOT e T9αH erano co-espressi con altri 7 geni biosintetici noti (TXS, T5αH, T13αH, T2αH, T7βH, TAT e TBT). Inoltre, hanno dimostrato che questi nove geni sono i geni fondamentali per la biosintesi della baccatina III poiché ogni gene è indispensabile per la biosintesi della baccatina III nel tabacco.
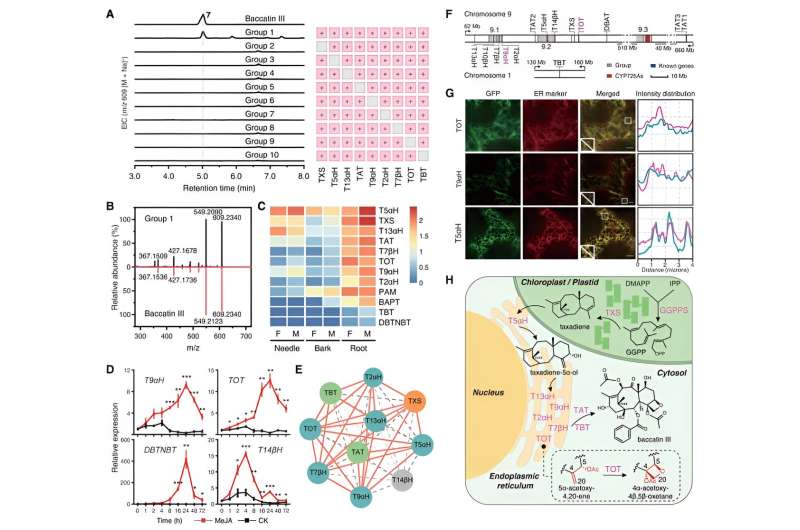
Ulteriori studi biochimici hanno dimostrato che questi geni centrali mostrano una stretta sinergia funzionale e sono co-regolati dall'ormone vegetale jasmonato, dimostrando modelli di espressione di induzione simili e una forte correlazione di espressione. Combinando l'analisi della localizzazione subcellulare e altri risultati sperimentali, i ricercatori forniscono una panoramica completa del processo biosintetico della baccatina III.
Il substrato di partenza GGPP è catalizzato da TXS per formare taxadiene nei cloroplasti. Successivamente, il taxadiene viene trasferito al citoplasma attraverso i siti di contatto del reticolo plastido-endoplasmatico e subisce una catalisi concertata da parte di sei ossidasi legate alla membrana (T2αH, T5αH, T7βH, T9αH, T13αH e TOT) ancorate nel reticolo endoplasmatico e due acile citoplasmatico transferasi (TAT e TBT), che alla fine portano alla formazione di baccatina III.
In sintesi, questo studio, che è stato pubblicato su Science recentemente, combina analisi omiche multiple e un'ampia validazione funzionale per identificare con successo gli enzimi chiave mancanti nella via biosintetica del paclitaxel. Rivela un nuovo meccanismo mediante il quale le cellule vegetali catalizzano la formazione di anelli di ossetano e scopre il percorso più breve per la biosintesi eterologa del paclitaxel.
Co-esprimendo 9 enzimi principali nel tabacco, i ricercatori ottengono la bioproduzione del precursore del paclitaxel, baccatina III, ponendo le basi per la produzione su larga scala di paclitaxel e fornendo anche una guida teorica per studi biosintetici su centinaia di altri prodotti naturali taxani.
Ulteriori informazioni: Bin Jiang et al, Caratterizzazione e ricostituzione eterologa degli enzimi biosintetici del Taxus che portano alla baccatina III, Scienza (2024). DOI:10.1126/science.adj3484
Informazioni sul giornale: Scienza
Fornito dall'Università di Pechino