I ricercatori dell’Università della California, Irvine, hanno scoperto profonde somiglianze e sorprendenti differenze tra gli esseri umani e gli insetti nella produzione della molecola critica che assorbe la luce nella retina, l’11-cis-retinale, nota anche come “cromoforo visivo”. I risultati approfondiscono la comprensione di come le mutazioni nell'enzima RPE65 causano malattie della retina, in particolare l'amaurosi congenita di Leber, una devastante malattia che porta alla cecità infantile.
Per lo studio, recentemente pubblicato sulla rivista Nature Chemical Biology , il team ha utilizzato la cristallografia a raggi X per studiare NinaB, una proteina presente negli insetti che funziona in modo simile alla proteina RPE65 presente negli esseri umani. Entrambi sono cruciali per la sintesi di 11-cis-retinale e la loro assenza provoca gravi danni alla vista.
"Il nostro studio sfida le ipotesi tradizionali sulle somiglianze e le differenze tra la visione umana e quella degli insetti", ha affermato l'autore corrispondente Philip Kiser, professore associato di fisiologia e biofisica e oftalmologia dell'UCI. "Sebbene questi enzimi condividano un'origine evolutiva e un'architettura tridimensionale comuni, abbiamo scoperto che il processo mediante il quale producono 11-cis-retinale è distinto."
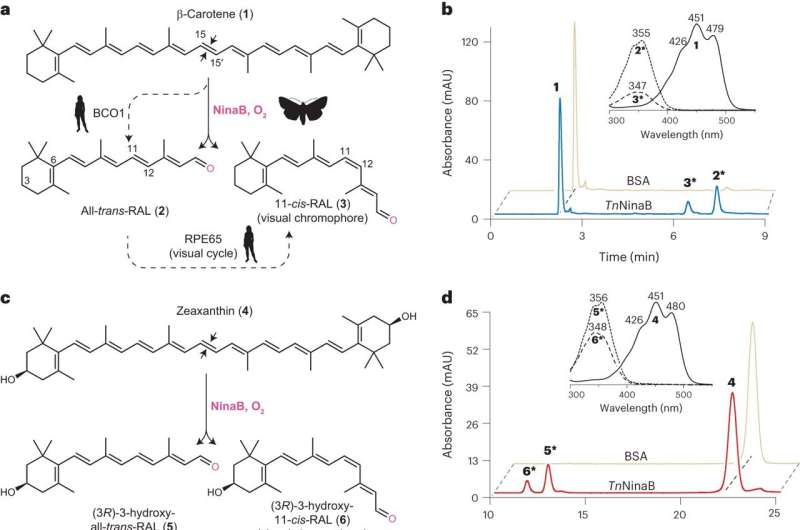
La creazione dell'11-cis-retinale inizia con il consumo di alimenti come carote o zucche contenenti composti utilizzati per la generazione di vitamina A, come il beta-carotene. Questi nutrienti vengono metabolizzati dagli enzimi di scissione dei carotenoidi, tra cui NinaB e RPE65.
In precedenza era noto che gli esseri umani necessitano di due di questi enzimi per produrre 11-cis-retinale dal beta-carotene, mentre gli insetti possono ottenere la conversione solo con NinaB. Ottenere informazioni su come NinaB può accoppiare i due passaggi in un'unica reazione insieme alle relazioni funzionali tra NinaB e RPE65 è stata una motivazione chiave per lo studio.
"Abbiamo scoperto che strutturalmente questi enzimi sono molto simili, ma i luoghi in cui svolgono la loro attività sono diversi", ha affermato l'autore principale Yasmeen Solano, uno studente laureato nel laboratorio di Kiser presso il Centro UCI per la ricerca sulla visione traslazionale.
"La comprensione delle caratteristiche chiave della struttura NinaB ha portato a una migliore comprensione del meccanismo catalitico necessario per supportare la funzione dei pigmenti visivi della retina. Attraverso il nostro studio di NinaB, siamo stati in grado di conoscere la struttura di una porzione chiave di RPE65 che non era stato precedentemente risolto. Questa scoperta è fondamentale per comprendere e affrontare le mutazioni con perdita di funzione in RPE65."
Altri membri del team includevano Michael Everett, uno specialista junior del laboratorio Kiser, e Kelly Dang e Jude Abueg, all'epoca studenti universitari di scienze biologiche.
Ulteriori informazioni: Yasmeen J. Solano et al, Gli enzimi di scissione dei carotenoidi si sono evoluti in modo convergente per generare il cromoforo visivo, Nature Chemical Biology (2024). DOI:10.1038/s41589-024-01554-z
Fornito dall'Università della California, Irvine