Un gran numero di applicazioni nell'industria chimica si basano sulle molecole NADH o NADPH come combustibile. Un team guidato dal professor Dirk Tischler, capo del gruppo di lavoro sulla biotecnologia microbica presso l'Università della Ruhr a Bochum, ha utilizzato un biocatalizzatore per studiare in dettaglio la propria produzione.
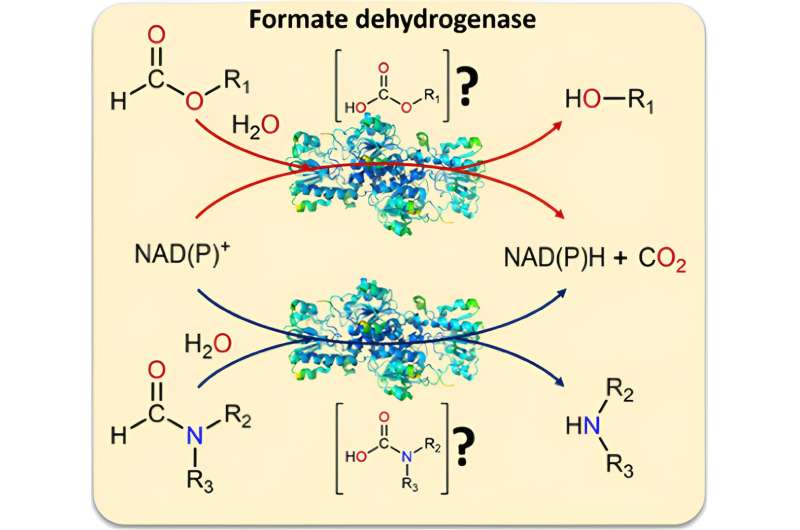
I ricercatori hanno dimostrato che, oltre al formiato, il formiato deidrogenasi del biocatalizzatore può convertire anche le formammidi. Ciò significa, da un lato, che l’enzima può anche scindere il legame C–N, difficile da rompere. Dall'altro, le formammidi sono un solvente comune.
"Ciò apre possibilità completamente nuove per reazioni NADH scarsamente solubili e reazioni NADPH-dipendenti", afferma Tischler.
I ricercatori hanno pubblicato i loro risultati sulla rivista ACS Catalysis il 26 gennaio 2024.
La formiato deidrogenasi viene utilizzata nei processi biocatalitici per rendere disponibili gli elettroni come combustibile per ulteriori reazioni rimuovendoli da un substrato. Nelle applicazioni attuali, il substrato è NAD+ e il prodotto è NADH. Il prodotto di scarto è CO2 .
"In questo caso questo è positivo, perché fuoriesce sotto forma di gas e quindi impedisce che la reazione desiderata avvenga al contrario", spiega Tischler.
Poiché la variante NADPH, con un gruppo fosfato in più, è spesso richiesta come prodotto, il suo team ha creato mutanti del biocatalizzatore che converte NADP+ nel prodotto desiderato.

E se il catalizzatore rompesse anche il legame C–N?
Mentre lavoravano sulla formiato deidrogenasi, i ricercatori si sono resi conto che si sapeva poco sui materiali di partenza alternativi per il biocatalizzatore. "Abbiamo esaminato vari possibili substrati (derivati del formiato) e abbiamo scoperto che un legame C–O viene sempre rotto quando vengono convertiti dal biocatalizzatore", spiega Tischler. "Questo ci ha dato un'idea:e se l'enzima potesse anche scindere i legami C–N, un compito tradizionalmente difficile da risolvere?"
Ulteriori test hanno dimostrato che il biocatalizzatore è effettivamente in grado di farlo:può anche convertire le formammidi, derivati del formiato con un composto aggiuntivo, per formare un azoto, come materiale di partenza. Poiché le formammidi sono solventi comuni ed economici, servono sia come solvente che come substrato in questa reazione. In questa costellazione è anche possibile fornire NADH e NADPH. CO2 viene prodotto come prodotto di scarto anche in queste reazioni e, fuggendo, impedisce alle reazioni di tornare indietro.
"Questa reazione non è mai stata descritta prima", afferma Tischler. Il suo team ha dimostrato che l'utilizzo delle formammidi come fonte di elettroni per la formazione di NADPH può ottenere risultati equivalenti o addirittura leggermente migliori rispetto al sistema convenzionale con formiato.
"Ciò apre possibilità completamente nuove, poiché i nostri mutanti più stabili sono ancora attivi fino al 40% in volume di formammidi", afferma il ricercatore.
Ulteriori informazioni: Artur Maier et al, Sblocco della diversità catalitica di una formiato deidrogenasi:attività della formammide per la rigenerazione del NADPH e fornitura di ammina per l'amminazione riduttiva asimmetrica, catalisi ACS (2024). DOI:10.1021/acscatal.3c05409
Informazioni sul giornale: Catalisi ACS
Fornito da Ruhr-Universitaet-Bochum