Se vogliamo rallentare il riscaldamento globale, dobbiamo ridurre drasticamente le emissioni di gas serra. Tra le altre cose, dobbiamo fare a meno dei combustibili fossili e utilizzare tecnologie più efficienti dal punto di vista energetico.
Tuttavia, la sola riduzione delle emissioni non basterà a raggiungere gli obiettivi climatici. Dobbiamo anche catturare grandi quantità di gas serra CO2 dall’atmosfera e immagazzinarlo permanentemente nel sottosuolo o utilizzarlo come materia prima a zero emissioni di carbonio nell’industria. Sfortunatamente, le tecnologie di cattura del carbonio oggi disponibili richiedono molta energia e sono quindi costose.
Ecco perché i ricercatori dell'ETH di Zurigo stanno sviluppando un nuovo metodo che utilizza la luce. Con questo processo, in futuro, l’energia necessaria per la cattura del carbonio arriverà dal sole. Il loro lavoro è stato pubblicato in Chimica dei Materiali .
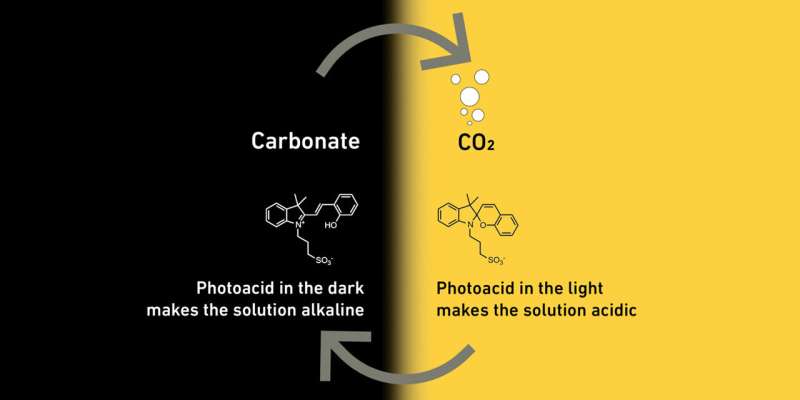
Guidati da Maria Lukatskaya, professoressa di sistemi energetici elettrochimici, gli scienziati stanno sfruttando il fatto che nei liquidi acquosi acidi la CO2 è presente come CO2 , ma nei liquidi acquosi alcalini reagisce per formare sali di acido carbonico, noti come carbonati. Questa reazione chimica è reversibile. L'acidità di un liquido determina se contiene CO2 o un carbonato.
Per influenzare l’acidità del loro liquido, i ricercatori hanno aggiunto delle molecole, chiamate fotoacidi, che reagiscono alla luce. Se tale liquido viene poi irradiato con la luce, le molecole lo rendono acido. Al buio ritornano allo stato originale che rende il liquido più alcalino.
Ecco come funziona nel dettaglio il metodo dei ricercatori dell'ETH:i ricercatori separano la CO2 dall'aria facendo passare l'aria attraverso un liquido contenente fotoacidi al buio. Poiché questo liquido è alcalino, la CO2 reagisce e forma carbonati. Non appena i sali nel liquido si sono accumulati in misura significativa, i ricercatori irradiano il liquido con la luce. Questo lo rende acido e i carbonati si trasformano in CO2 .
La CO2 fuoriesce dal liquido, proprio come fa in una bottiglia di cola, e può essere raccolto in serbatoi di gas. Quando non c'è quasi più CO2 rimasto nel liquido, i ricercatori spengono la luce e il ciclo ricomincia da capo, con il liquido pronto a catturare la CO2 .
In pratica però si è presentato un problema:i fotoacidi utilizzati sono instabili in acqua. "Nel corso dei nostri primi esperimenti, ci siamo resi conto che le molecole si sarebbero decomposte dopo un giorno", afferma Anna de Vries, dottoranda nel gruppo di Lukatskaya e autrice principale dello studio.
Quindi Lukatskaya, de Vries e i loro colleghi hanno analizzato il decadimento della molecola. Hanno risolto il problema eseguendo la reazione non in acqua ma in una miscela di acqua e solvente organico. Gli scienziati sono stati in grado di determinare il rapporto ottimale tra i due liquidi mediante esperimenti di laboratorio e hanno potuto spiegare i loro risultati grazie ai modelli di calcolo effettuati dai ricercatori dell'Università della Sorbona di Parigi.
Per prima cosa, questa miscela ha permesso loro di mantenere stabili le molecole di fotoacido nella soluzione per quasi un mese. Dall'altro, assicurava che la luce potesse essere utilizzata per commutare la soluzione avanti e indietro secondo necessità tra l'acido e l'alcalino. Se i ricercatori utilizzassero il solvente organico senza acqua, la reazione sarebbe irreversibile.
Anche altri processi di cattura del carbonio sono ciclici. Un metodo consolidato funziona con filtri che raccolgono la CO2 molecole a temperatura ambiente. Per rimuovere successivamente il CO2 dai filtri, questi devono essere riscaldati a circa 100° Celsius. Tuttavia, il riscaldamento e il raffreddamento sono ad alta intensità energetica:rappresentano la quota maggiore dell'energia richiesta dal metodo di filtraggio.
"Al contrario, il nostro processo non necessita di riscaldamento o raffreddamento, quindi richiede molta meno energia", afferma Lukatskaya. Inoltre, il nuovo metodo dei ricercatori dell'ETH funziona potenzialmente solo con la luce solare.
"Un altro aspetto interessante del nostro sistema è che possiamo passare da alcalino ad acido in pochi secondi e tornare ad alcalino in pochi minuti. Ciò ci consente di passare dalla cattura al rilascio del carbonio molto più rapidamente rispetto a un sistema basato sulla temperatura", spiega de Vries.
Con questo studio i ricercatori hanno dimostrato che i fotoacidi possono essere utilizzati in laboratorio per catturare la CO2 . Il prossimo passo verso la maturità del mercato sarà quello di aumentare ulteriormente la stabilità delle molecole di fotoacidi. Devono inoltre esaminare i parametri dell'intero processo per ottimizzarlo ulteriormente.
Ulteriori informazioni: Anna de Vries et al, Fotoacido sintonizzato sulla solvatazione come interruttore di pH stabile guidato dalla luce per la cattura e il rilascio di CO2, Chimica dei materiali (2023). DOI:10.1021/acs.chemmater.3c02435
Informazioni sul giornale: Chimica dei materiali
Fornito da ETH Zurigo