Gli scienziati del St. Jude Children's Research Hospital stanno affrontando la resistenza agli antibiotici del Mycobacterium abscessus (Mab). Questo agente patogeno naturalmente resistente agli antibiotici sta diventando sempre più diffuso, evidenziando l’urgente necessità di nuove terapie. Per risolvere questo problema, gli scienziati hanno progettato nuove versioni del farmaco spectinomicina che superano l'efflusso, il principale meccanismo che determina la resistenza. Il lavoro è pubblicato in Proceedings of the National Academy of Science .
Le infezioni da Mab si riscontrano sempre più spesso negli ambienti sanitari. Tali infezioni possono essere pericolose per i pazienti con funzionalità polmonare compromessa, come nel caso della fibrosi cistica, o che sono immunologicamente compromessi, come nel cancro infantile. Queste infezioni vengono trattate con lunghi cicli di antibiotici e possono portare a scarsi risultati.
L'emergere di Mab e di altri agenti patogeni simili rappresenta una minaccia crescente e profondamente preoccupante per la salute pubblica perché esistono poche opzioni terapeutiche efficaci e un canale di sviluppo di farmaci limitato.
"Noi chimici siamo in una corsa contro gli agenti patogeni. Produciamo antibiotici più potenti e gli agenti patogeni diventano più resistenti", ha affermato l'autore corrispondente Richard Lee, Ph.D., Dipartimento di biologia chimica e terapeutica di St. Jude.
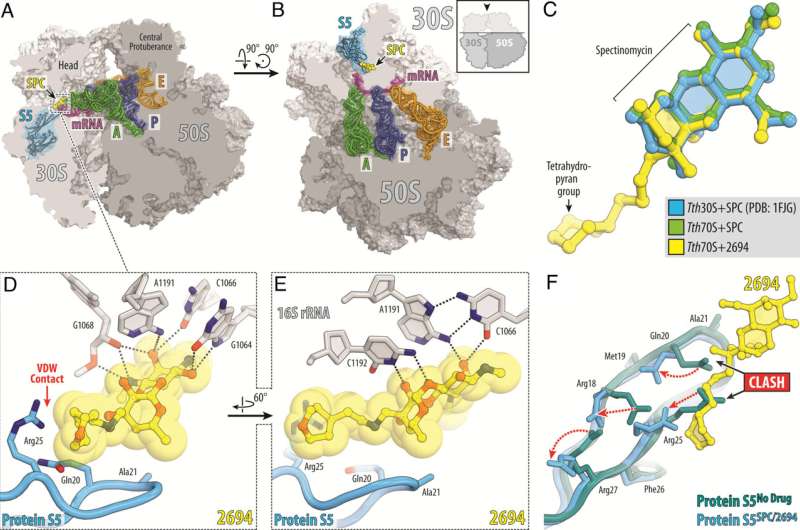
Gli scienziati del St. Jude hanno modificato la spectinomicina antibiotica presente in natura per creare analoghi, amminometil spectinomicine legate all'N-etilene (eAmSPC) comparabili ma strutturalmente distinte. Questi eAmSPC creati sinteticamente sono fino a 64 volte più potenti contro Mab rispetto alla spectinomicina standard.
"Riprogettando la molecola attraverso la progettazione di farmaci basati sulla struttura, noi e i nostri collaboratori abbiamo adattato l'antibiotico per aumentarne l'attività", ha aggiunto Lee.
Attraverso il loro lavoro, gli scienziati hanno svelato il meccanismo d’azione grazie al quale gli eAmSPC sono più efficaci:evitano l’efflusso. L'efflusso è il processo utilizzato dalle cellule per sbarazzarsi di un farmaco (immagina di pompare l'acqua fuori da un seminterrato allagato) ed è un meccanismo significativo attraverso il quale le cellule diventano resistenti alla terapia.
La struttura del collegamento N-etilene degli eAmSPC svolge un ruolo fondamentale nel modo in cui i composti evitano l'efflusso, suggerendo che collegamenti più lunghi modificano il modo in cui il composto viene pompato fuori dalla cellula. Ciò alla fine sposta l'equilibrio verso concentrazioni più elevate di eAmSPC all'interno della cellula e quindi migliora l'efficacia antimicrobica.
"Negli ultimi due decenni, abbiamo assistito a un massiccio aumento del numero di infezioni causate da micobatteri non tubercolari come Mab", ha affermato il co-primo autore Gregory Phelps, PharmD, St. Jude Graduate School of Biomedical Sciences. "Avevamo un punto di partenza con questo antibiotico naturale che, attraverso la modifica, abbiamo reso molto più efficace contro questo agente patogeno clinicamente rilevante."
I ricercatori hanno anche scoperto che gli eAmSPC funzionano bene con varie classi di antibiotici usati per trattare Mab e mantengono la loro attività contro altri ceppi micobatterici. Questo lavoro dimostra che gli eAmSPC dovrebbero essere ulteriormente studiati e sviluppati perché una volta affrontati i problemi di tollerabilità e sicurezza, questi composti potrebbero diventare terapie di prossima generazione.
"È difficile convincere le aziende farmaceutiche a sviluppare nuovi antibiotici per diverse ragioni economiche", ha affermato Phelps. "Se riusciamo a potenziare la pipeline di farmaci contro questo batterio difficile da trattare, possiamo potenzialmente fare la differenza per pazienti come quelli che abbiamo qui al St. Jude, che si trovano sempre più di fronte a opzioni terapeutiche limitate o assenti."
Ulteriori informazioni: Gregory A. Phelps et al, Sviluppo di aminometil spectinomicine di seconda generazione che superano l'efflusso nativo nel Mycobacterium abscessus, Atti dell'Accademia nazionale delle scienze (2024). DOI:10.1073/pnas.2314101120
Informazioni sul giornale: Atti dell'Accademia Nazionale delle Scienze
Fornito dal St. Jude Children's Research Hospital