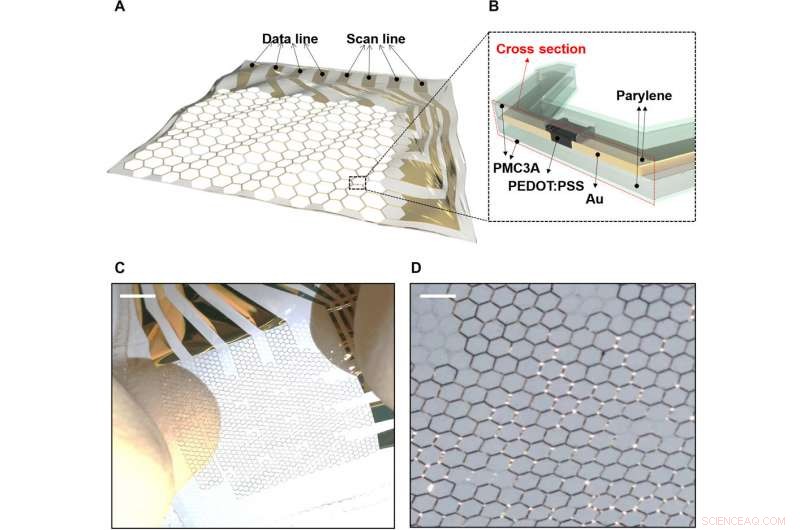
Array OECT estensibile su substrato a griglia a nido d'ape. A) L'array OECT elettrofisiologico estensibile su un substrato di parylene a griglia a nido d'ape. B) Sezione trasversale dell'array OECT estensibile. C) Un array OECT estensibile 4 x 4 quando intrinsecamente allungato. D) Vista ingrandita dell'array OECT estensibile 4 x 4 quando allungato. Credito:progressi scientifici, doi:10.1126/sciadv.aau2426
Per valutare le funzioni fisiologiche in vivo, i segnali elettrofisiologici devono essere monitorati con elevata precisione ed elevata risoluzione spaziale o temporale. Ultraflessibile, sono stati recentemente fabbricati array multielettrodi (MEA) per stabilire un contatto conforme sulle superfici degli organi e per misurare la propagazione del segnale elettrofisiologico ad alta risoluzione spazio-temporale. Però, substrati di plastica con un alto modulo di Young incorporato nel processo hanno causato difficoltà durante l'impianto a causa dell'emodinamica dinamica basata sul movimento sulla superficie del cuore. In un nuovo studio pubblicato su Progressi scientifici , Wonryung Lee e colleghi hanno sviluppato un MEA attivo fabbricato per dimostrare la non trombogenicità, elasticità e stabilità. Gli array hanno consentito il monitoraggio elettrocardiografico (ECG) a lungo termine nel cuore pulsante dei ratti, anche con sanguinamento capillare. I segnali ECG misurati hanno mostrato un elevato rapporto segnale-rumore (SNR) di 52 dB come risultato della lettura dei dati attiva.
Nello studio, il nuovo MEA estensibile è stato accuratamente progettato utilizzando tecniche ingegneristiche all'avanguardia. I metodi hanno combinato transistor elettrochimici organici (OECT) straordinariamente ad alto guadagno elaborati su substrati microgrid con un rivestimento in poli(3-metossipropil acetato) (PMC3A). Il processo ha facilitato significative proprietà antitrombotiche mantenendo un'eccellente conduttività ionica.
Tipicamente, gli array multielettrodi (MEA) sono utilizzati per studiare la posizione delle celle attive/inattive, propagazione di segnali neurali e networking tra più neuroni. Gli array possono essere utilizzati anche per diagnosticare e curare malattie misurando segnali biologici in più punti. Il primo MEA riportato in vitro è stato fabbricato su vetro piano per misurare l'eccitazione cellulare nel miocardio in coltura, cellule neuronali e propagazione del segnale da fettine di cuore e cervello. Gli array MEA in vivo non invasivi recentemente sviluppati sono stati fabbricati su un foglio di plastica flessibile con la capacità di entrare in contatto con tessuti viventi molli e in movimento. Durante il processo di ingegneria, la flessibilità del dispositivo dovrebbe essere aumentata per facilitare i MEA su strutture complesse nel corpo durante l'impianto.
Contatto conforme su superfici cerebrali rugose, ad esempio, può essere ottenuto riducendo lo spessore del dispositivo al di sotto di due µm. Allo stesso modo, Le misurazioni ECG possono essere eseguite sulla pelle vicino al cuore tramite MEA passivi su substrati di poliimmide da 3 µm. Le proprietà ultraflessibili dei MEA attivi sono state dimostrate tramite il contatto regolare con le cellule muscolari, corteccia cerebrale e misurazioni di elettromiografia (EMG) ed elettrocorticografia (ECoG). Un MEA attivo estensibile e compatibile con il sangue deve ancora essere realizzato a causa di due limitazioni principali. All'inizio, la degradazione del dispositivo dovuta a coaguli di sangue da sanguinamento chirurgico a causa di un elevato modulo di Young è stata osservata con polimeri di poliimmide o parylene nonostante la loro elevata compatibilità. Successivamente, è anche difficile progettare elementi attivi ad alte prestazioni con elasticità per misurare i segnali biologici. Gli elementi attivi richiedevano anche fattori di amplificazione elevati e tensioni di pilotaggio basse.
Nello studio, Lee et al. progettato un ultrasottile, matrice attiva OECT (transistor elettrochimico organico) a griglia estensibile per misurare la distribuzione dei segnali ECG con un rapporto segnale-rumore (SNR) di 52 dB tramite contatto diretto sul cuore pulsante del topo. L'array attivo 4 x 4 OECT è stato fabbricato con uno spessore totale di 2,6 µm e un'elevata transconduttanza. Il dispositivo è stato interamente rivestito con poli (3-metossipropil acetato) (PMC3A) dello spessore di 100 nm per conferire proprietà antitrombotiche mantenendo un'eccellente conduttività ionica. Un ECG è stato mappato dalla superficie del cuore di un ratto per determinare la fattibilità del 4 x 4, ultra sottile, estensibile, matrice OECT antitrombotica e attiva. A causa dell'elevata conformabilità della struttura della griglia, il rumore degli artefatti causato dal movimento dinamico non è apparso nei dati registrati. Inoltre, grazie alla sua proprietà antitrombotica, il dispositivo era in grado di effettuare misurazioni stabili per lunghi periodi di tempo, anche in un ambiente implantare con sanguinamento consistente.
Il MEA estensibile contenente OECTS e substrati a griglia è stato fabbricato su substrati di parylene da 1,2 µm. Gli strati attivi di un sottile poli(3, Il sistema 4-etilendiossitiofene)polistirene solfonato (PEDOT:PSS) e il cablaggio sono stati realizzati su un substrato a griglia a nido d'ape. La struttura a griglia a nido d'ape ha consentito la stabilità meccanica e l'elasticità strutturale, precedentemente indagato sperimentalmente e tramite simulazione. Lo strato più esterno di PMC3A [poli (3-metossipropil acetato)] ha consentito un'elevata compatibilità del sangue per mantenere l'antitrombogenicità. L'elasticità del dispositivo ha consentito il movimento dinamico su substrati biologici.
Prima di condurre esperimenti biologici in vivo, gli autori hanno valutato sistematicamente il carattere elettrico e meccanico del dispositivo. Le prestazioni elettriche sono state misurate rispetto alla transconduttanza dell'array, che indicava quantità sufficientemente grandi per misurare i segnali ECoG o EMG dei ratti. Lo spessore e l'angolo di contatto con l'acqua delle superfici PMC3A hanno mostrato risultati coerenti con gli studi precedenti. Gli studi di emocompatibilità su PMC3A sono stati condotti utilizzando l'adesione piastrinica immergendo i campioni in sospensioni piastriniche estratte dal sangue umano. Il tempo di risposta (τ) degli OECT prima e dopo il rivestimento PMC3A è stato misurato dopo l'applicazione di un impulso di tensione di gate con una durata di un millisecondo, indicando che il processo di immersione del PMC3A non ha modificato le proprietà elettriche dell'OECT. I PMC3A rivestiti con OECT hanno anche confermato la stabilità elettrica a lungo termine.
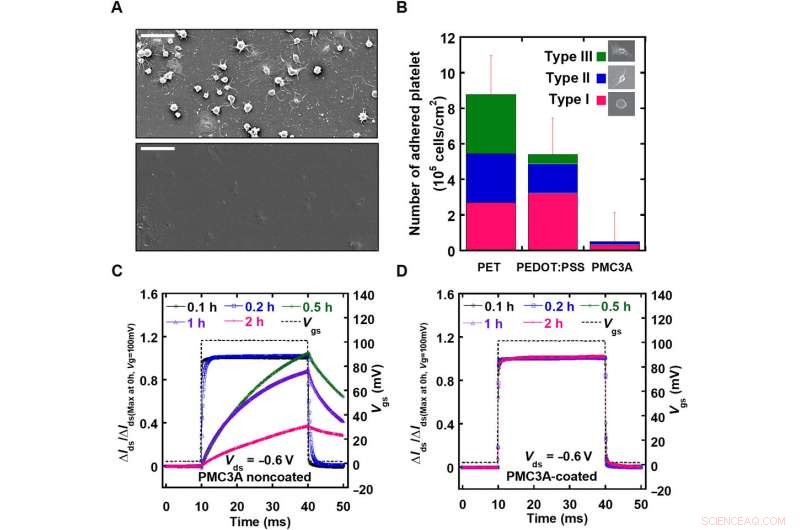
Valutazione della compatibilità ematica del rivestimento PMC3A sugli OECT. A) L'immagine SEM di polietilene tereftalato (PET) e pellicola rivestita con PMC3A osservata dopo 1 ora di adesione piastrinica. B) Il numero medio di piastrine aderenti su film PET rispetto a film PEDOT:PSS e PMC3A dopo 1 ora di adesione piastrinica. C) Dopo adesione piastrinica con tempi di adesione di 0,1-2 ore, i valori di OECT con o senza rivestimento PMC3A sono stati misurati applicando un impulso di tensione di gate con una durata di 50 ms. D) L'eccellente compatibilità con il sangue di superficie ha consentito il monitoraggio del segnale ECG a lungo termine. Credito:progressi scientifici, doi:10.1126/sciadv.aau2426
I ricercatori hanno quindi condotto studi in vivo su un modello di ratto in cui la fattibilità delle matrici OECT estensibili ed emocompatibili è stata eseguita tramite misurazioni ECG sulle superfici cardiache. I segnali fisiologici sono stati misurati utilizzando la matrice 4 x 4 di OECT estensibili ed emocompatibili attaccandoli alla superficie esposta del cuore. I fori a nido d'ape nel substrato ultrasottile hanno consentito il contatto conforme tra la pellicola del dispositivo e la superficie del cuore.
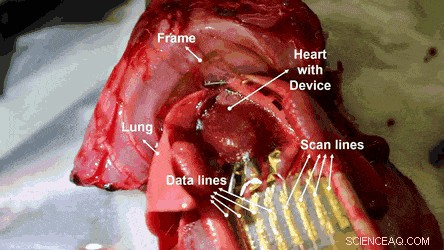
Mappatura elettroanatomica su una superficie cardiaca utilizzando MEA attivo sul substrato della griglia a nido d'ape ultrasottile. Credito:progressi scientifici, doi:10.1126/sciadv.aau2426
Il rapporto segnale-rumore dell'OECT rivestito con PMC3A registrato a 51 dB 30 min dopo l'attacco era simile al valore registrato subito dopo l'attacco. L'ordine di transconduttanza in millisiemens osservato nello studio era dovuto alla permeabilità all'acqua di PEDOT:PSS. Di conseguenza, la transconduttanza dell'OECT era 100 volte superiore a quella dei transistor ad effetto di campo (FET) al Si.
I ricercatori hanno anche dimostrato i segnali di mappatura ECG utilizzando l'array OECT quando il dispositivo è stato posizionato su una superficie del cuore di ratto che copre le aree del ventricolo sinistro e destro. L'impedenza di carico è stata progettata per essere 0 ohm per sopprimere sostanzialmente la diafonia nell'array OECT come precedentemente dimostrato. Sono state visualizzate le mappe spaziali di tensione di tutti i nodi a quattro timepoint sequenziali. In base alla posizione del sensore, i segnali anatomici mostravano forme diverse. Gli array OECT estensibili e compatibili con il sangue hanno registrato con successo la distribuzione spazio-temporale degli ECG sulle superfici del cuore di ratto con multiplexing.
La mappatura elettroanatomica su una superficie cardiaca mediante multiplexing. Credito:progressi scientifici, doi:10.1126/sciadv.aau2426
Nello studio, un SNR elevato di 52 dB è stato raggiunto per due ragioni; primo, poiché gli autori sono riusciti a utilizzare OECT con elevata transconduttanza nell'ordine del millisiemen. Superiore di un fattore 10 rispetto al Si FET a cristallo singolo in presenza di sanguinamento chirurgico, mentre il rivestimento PMC3A manteneva contemporaneamente un'elevata conduttività ionica. Secondo, il rumore dell'artefatto da movimento è stato soppresso dall'elevata conformabilità dell'architettura a microgrid:il dispositivo può aderire al bersaglio dinamico durante il movimento del cuore. I MEA estensibili e attivi con rivestimento non trombogenico PMC3A consentiranno misurazioni di ECG, Segnali ECoG o EMG con maggiore precisione in ulteriori studi preclinici.
© 2018 Science X Network