Credito:CNBP
I ricercatori medici affrontano un ostacolo quando studiano le cellule al microscopio ottico:le leggi della fisica. Ottenere un'immagine di qualsiasi cosa al di sotto di una certa dimensione è complicato; le aperture ottiche e la lunghezza d'onda della luce visibile rovinano la chiarezza. Conosciuto come limite di diffrazione, fu incontrato per la prima volta dal fisico tedesco Ernst Abbe nel 1873, e limita la risoluzione al massimo a 200 nanometri (nm) (o 200 miliardesimi di metro).
Negli ultimi 20 anni, nuove tecniche di "super risoluzione" hanno superato questo ostacolo, elementi di imaging fino a pochi nanometri. Uno di loro, Microscopia STED (o riduzione delle emissioni stimolate), ha anche vinto il Premio Nobel 2014 per la Fisica. Ma la super-risoluzione ha dei limiti:necessita di strumenti complessi o di un'ampia elaborazione del computer, che può aggiungere difetti sfocati. E spesso impiega coloranti molecolari come etichette fluorescenti, che si degradano facilmente sotto la luce laser, rendendoli impossibili da usare per lunghe esposizioni.
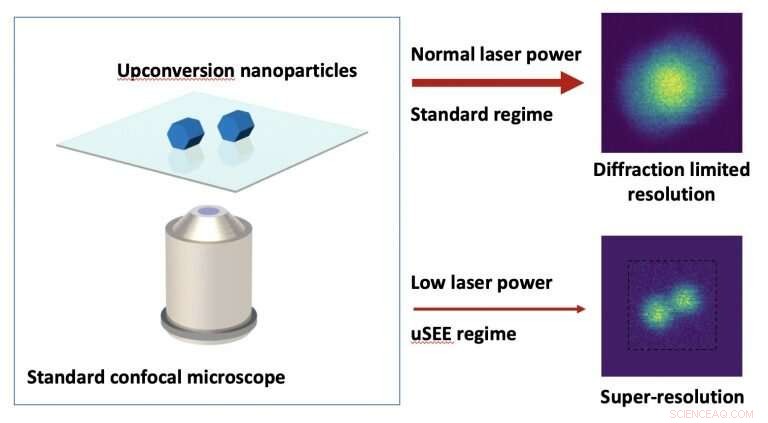
Presso il Centro per la biofotonica su nanoscala (CNBP), gli scienziati stanno esplorando una nuova strategia che estende il tempo a disposizione dei ricercatori per analizzare le cellule al microscopio. Si basa su un uso intelligente di un diverso tipo di marcatore fluorescente noto come nanoparticelle di conversione, o UCNP.
"Le proprietà ottiche degli UCNP offrono molte opportunità per applicazioni di biorilevamento e, nello specifico, per immagini ad alta risoluzione, " ha affermato il Dott. Simone De Camillis, un ricercatore post-dottorato presso il nodo Macquarie University della CNBP, che fa parte del team guidato dal Prof Jim Piper, investigatore capo del gruppo Advanced Detection and Imaging.
Il team ha sviluppato una nuova classe di UCNP la cui luminosità cambia bruscamente quando viene eccitata dalla luce del vicino infrarosso. Questo comportamento può essere sfruttato per l'immagine di oggetti con una risoluzione metà del limite di diffrazione, in modo che queste particelle estremamente piccole possono essere viste molto più chiaramente. E per di più, il metodo può essere applicato a microscopi confocali standard ampiamente utilizzati nei laboratori di oggi.
Poiché si basa su una luce a potenza relativamente bassa, la tecnica, nota come microscopia a emissione di eccitazione e eccitazione superlineare (uSEE), è relativamente innocua per le cellule viventi e potrebbe consentire l'imaging più profondo nei tessuti.
Gli UCNP possono anche operare parallelamente all'approccio STED, consentendo l'imaging fino a 60 nm, paragonabile con le prestazioni di STED convenzionale utilizzando coloranti molecolari.
Il team sta ora perfezionando la progettazione dei nuovi UCNP e la loro capacità di produrli con maggiore affidabilità. Questi miglioramenti, insieme a una migliore capacità di imaging che si avvicina alle dimensioni di una singola nanoparticella, spianare la strada all'"imaging quantitativo":la capacità di contare il numero effettivo di UCNP nelle cellule, oltre a identificare la posizione di ogni singola sonda di nanoparticelle e sapere dove si trovano.
"Attualmente, quando sono molto vicini, può essere difficile distinguerli, " Ha detto De Camillis. "Quindi ora stiamo sperimentando la composizione e la struttura degli UCNP per essere in grado di risolvere davvero i singoli UCNP, anche quando si raggruppano."