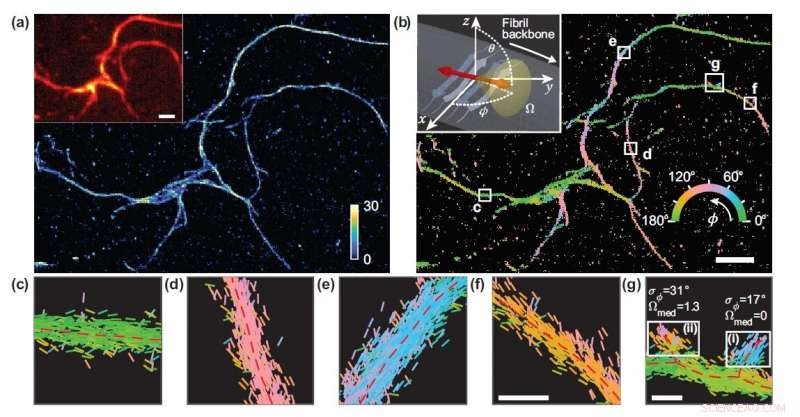
I ricercatori hanno sviluppato una tecnica di microscopia che misura la posizione e l'orientamento di singole molecole e l'hanno usata per studiare i dettagli strutturali degli aggregati di proteine amiloidi. (a) Immagine al microscopio di localizzazione di una singola molecola di una rete di aggregati amiloidi. (b) Immagine che mostra gli orientamenti di legame del rosso Nilo alle superfici amiloidi, codificati a colori in base all'orientamento medio misurato all'interno di ciascun contenitore. (c-g) Misure di orientamento individuali localizzate lungo le dorsali delle fibrille all'interno delle caselle bianche in (b). Le linee sono orientate e codificate a colori in base alla direzione dell'angolo stimato. Le barre orizzontali della scala bianca sono indicatori di lunghezza, 1 micron in (a), (b) e 100 nm in (f), (G). Credito:Tianben Ding, Tingting Wu e Matthew D. Lew, Washington University di St. Louis
Le malattie neurodegenerative come l'Alzheimer e il Parkinson sono spesso accompagnate da proteine amiloidi nel cervello che si sono raggruppate o si sono piegate male. Una tecnica di nuova concezione che misura l'orientamento delle singole molecole consente di utilizzare la microscopia ottica, per la prima volta, per rivelare dettagli su scala nanometrica sulle strutture di queste proteine problematiche.
I ricercatori della Washington University di St. Louis descrivono il loro nuovo approccio in ottica , Il giornale dell'Optical Society.
"Le malattie neurodegenerative come l'Alzheimer e il Parkinson sono le principali cause di morte in tutto il mondo, " ha detto Tianben Ding, co-primo autore del nuovo articolo. "Speriamo che il nostro approccio di imaging con orientamento a singola molecola possa fornire nuove informazioni sulla struttura dell'amiloide e possibilmente contribuire allo sviluppo futuro di terapie efficaci contro queste malattie".
I processi biologici e chimici nel cervello sono guidati da movimenti complicati e interazioni tra le molecole. Sebbene la maggior parte delle proteine amiloidi possa essere non tossica, il misfolding anche di pochi potrebbe alla fine uccidere molti neuroni.
"Abbiamo bisogno di tecnologie di imaging in grado di osservare questi movimenti molecolari nei sistemi viventi per comprendere i meccanismi biologici fondamentali della malattia, " ha spiegato Matthew D. Lew, capo del gruppo di ricerca. "Malattie di tipo amiloide e prioni come l'Alzheimer, Il Parkinson e il diabete sono i nostri primi obiettivi per questa tecnologia, ma vediamo che viene applicato anche in molti altri settori".
Selezione del miglior microscopio
Il laboratorio di Lew ha sviluppato diversi metodi di microscopia a super risoluzione a singola molecola che misurano l'orientamento e la posizione delle molecole fluorescenti attaccate alle singole proteine. Le informazioni sull'orientamento si ottengono misurando non solo la posizione della fluorescenza nel campione ma anche le caratteristiche di quella luce, come la polarizzazione, che sono tipicamente ignorati nella maggior parte degli altri approcci di microscopia.
nella loro ottica articolo, i ricercatori hanno descritto una metrica delle prestazioni progettata per caratterizzare la sensibilità con cui vari microscopi possono misurare gli orientamenti delle molecole fluorescenti. Utilizzando il nuovo indicatore di performance, i ricercatori hanno scoperto che un microscopio che divide la luce di fluorescenza in due canali di polarizzazione (x e y) fornisce misurazioni di orientamento superiori e pratiche.
"La metrica che abbiamo sviluppato calcola le prestazioni di un particolare modello di microscopio 1, 000 volte più veloce di prima, " disse Tingting Wu, co-primo autore dell'opera. "Misurando gli orientamenti delle singole molecole legate agli aggregati amiloidi, il microscopio selezionato ci ha permesso di mappare le differenze nell'organizzazione della struttura dell'amiloide che non possono essere rilevate dai microscopi di localizzazione standard".
Poiché non vi è alcun legame artificiale tra le sonde fluorescenti e le superfici amiloidi, l'orientamento di legame delle sonde alle superfici amiloidi trasmette informazioni su come è organizzata la proteina amiloide stessa. I ricercatori hanno quantificato come gli orientamenti delle molecole fluorescenti variassero ogni volta che una si attaccava a una proteina amiloide. Le differenze in questi comportamenti di legame possono essere attribuite alle differenze di struttura tra gli aggregati amiloidi. Poiché il metodo fornisce informazioni sulla singola molecola, i ricercatori hanno potuto osservare le differenze su scala nanometrica tra le strutture amiloidi senza calcolare la media dei dettagli delle caratteristiche locali.
Opportunità per studi a lungo termine
"Abbiamo in programma di estendere il metodo per monitorare i cambiamenti su scala nanometrica all'interno e tra le strutture amiloidi mentre si organizzano per ore o giorni, " ha detto Ding. "Gli studi a lungo termine sugli aggregati amiloidi possono rivelare nuove correlazioni tra il modo in cui le proteine amiloidi sono organizzate e la velocità con cui crescono o si dissolvono spontaneamente".
I ricercatori notano che il set-up che hanno usato per la microscopia di localizzazione dell'orientamento consisteva in parti disponibili in commercio accessibili a chiunque esegua la microscopia a super risoluzione a singola molecola. Il loro codice di analisi è disponibile su https://github.com/Lew-Lab/RoSE-O.
"Nella microscopia ottica e nell'imaging, scienziati e ingegneri hanno spinto i confini dell'imaging per essere più veloci, sondare più in profondità e avere una risoluzione maggiore, " ha detto Lew. "Il nostro lavoro mostra che si può far luce sui processi fondamentali in biologia da, Invece, concentrandosi sull'orientamento molecolare, che può rivelare dettagli sul funzionamento interno della biologia che non possono essere visualizzati dalla microscopia tradizionale".