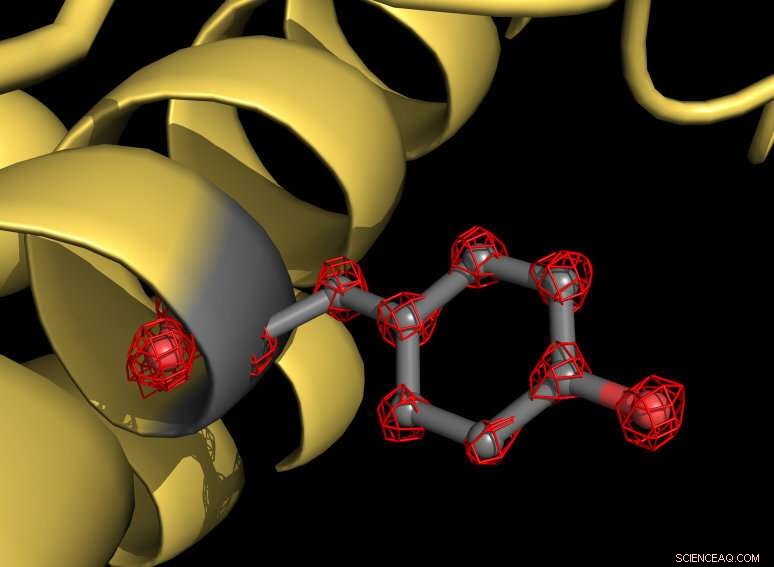
Una parte della proteina apoferritina (gialla) con una catena laterale tirosina evidenziata in grigio. L'aminoacido tirosina è costituito da diversi atomi che sono individualmente riconoscibili nella struttura (strutture a griglia rossa). Credito:MPI f. Chimica biofisica/ Holger Stark
Holger Stark dell'Istituto Max Planck per la chimica biofisica di Göttingen e il suo team hanno rotto una barriera cruciale di risoluzione nella criomicroscopia elettronica. Per la prima volta, il suo gruppo è riuscito a osservare i singoli atomi in una struttura proteica ea scattare le immagini più nitide di sempre con questo metodo. Tali approfondimenti dettagliati rendono più facile capire come le proteine svolgono il loro lavoro o causano malattie nella cellula vivente. La tecnica può essere utilizzata anche in futuro per sviluppare nuovi farmaci.
Dallo scoppio della pandemia di COVID-19, scienziati di tutto il mondo hanno risolto strutture 3D di importanti proteine chiave del nuovo coronavirus. Il loro obiettivo comune è trovare siti di attracco per un composto attivo in grado di combattere efficacemente l'agente patogeno.
Un metodo applicato per questo è la criomicroscopia elettronica (crio-EM), che può essere utilizzato per rendere visibili strutture tridimensionali di biomolecole. Poiché questi sono strutturalmente altamente flessibili, questo non è un compito facile. Per catturare le molecole sfocate senza danneggiarle, si raffreddano molto rapidamente, o congelato per così dire. I campioni congelati vengono quindi bombardati con elettroni, e le immagini risultanti vengono registrate. Usando questi, si può quindi calcolare la struttura tridimensionale delle molecole. Tre pionieri di questa tecnica, Jacques Dubochet, Gioacchino Frank, e Richard Henderson, ha ricevuto il Premio Nobel per la Chimica per lo sviluppo della crio-EM nel 2017.
Il record mondiale di risoluzione consente di vedere i singoli atomi nelle proteine
Il gruppo di Stark ha ora infranto la barriera della risoluzione crio-EM con un microscopio crioelettronico unico, sviluppato di recente da questo team. "Abbiamo dotato il nostro dispositivo di due elementi ottici elettronici aggiuntivi per migliorare ulteriormente la qualità e la risoluzione dell'immagine. Questi assicurano che gli errori di imaging delle lenti ottiche, le cosiddette aberrazioni, non hanno più un ruolo, " spiega il direttore di Max Planck. Il suo studente di dottorato Ka Man Yip aggiunge:"I microscopi elettronici sono strumenti ottici e assomigliano fisicamente a una macchina fotografica. Le aberrazioni di un microscopio elettronico interferiscono nella crio-EM più o meno allo stesso modo di quelle di una macchina fotografica in fotografia. Per una qualità dell'immagine molto migliorata era quindi fondamentale evitare questi errori di aberrazione."
Usando il nuovo microscopio, gli scienziati hanno preso più di un milione di immagini della proteina apoferritina per mappare la struttura molecolare con una risoluzione di 1,25 angstrom. Un angstrom equivale a un decimo di milionesimo di millimetro. "Ora visualizziamo singoli atomi nella proteina, una pietra miliare nel nostro campo, " spiega il biologo strutturale Stark. "Per noi, era come mettere dei super occhiali al microscopio. La nuova struttura rivela dettagli mai visti prima:possiamo persino vedere la densità degli atomi di idrogeno e le modifiche chimiche dei singoli atomi".
Il grande potenziale della crio-EM per l'imaging di strutture proteiche 3D ad alta risoluzione è stato dimostrato anche dai colleghi del Medical Research Council Laboratory of Molecular Biology di Cambridge (Regno Unito). Hanno raggiunto una risoluzione altrettanto elevata utilizzando un approccio diverso. "È ora concepibile che la crio-EM in futuro sarà in grado di raggiungere anche risoluzioni subatomiche, "dice il ricercatore.
Base per la progettazione di farmaci basata sulla struttura
Ma qual è il vantaggio di poter studiare una struttura proteica con una risoluzione atomica così senza precedenti? Per capire come funziona una macchina creata dall'uomo, bisogna osservarne i componenti direttamente all'opera. Questo vale anche per le proteine, le nanomacchine delle cellule viventi. Per avere un'idea di come svolgono i loro compiti, bisogna conoscere l'esatta posizione di tutti gli atomi della proteina.
Tali approfondimenti dettagliati sono rilevanti anche per la progettazione di farmaci basata sulla struttura. I composti per i farmaci sono personalizzati in modo da legarsi alle proteine virali, Per esempio, e bloccano la loro funzione. Ma qual è il meccanismo alla base dell'inibizione? I ricercatori possono chiarire e capire questo solo se possono osservare a livello atomico come interagiscono un composto e una proteina virale. Tali nuove intuizioni aiutano a migliorare le molecole dei farmaci e a ridurre gli effetti collaterali. "Con la rottura di questa barriera di risoluzione crio-EM, la tecnica ha raggiunto un livello in cui i benefici per gli sviluppi farmaceutici sono direttamente visibili, "dice Stark.