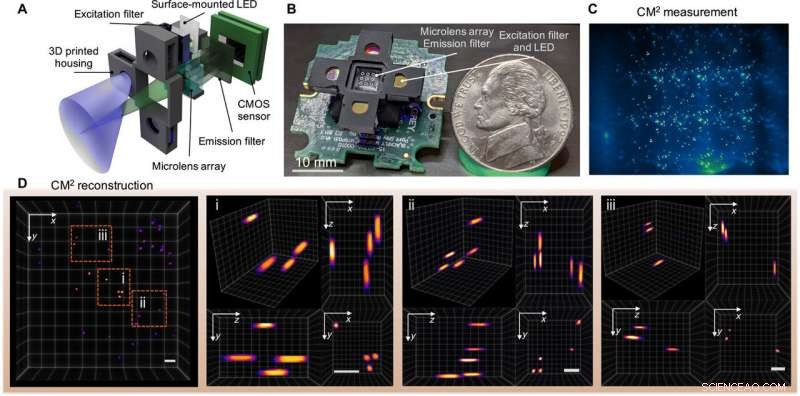
Copertina online - un Mesoscope computazionale in miniatura (CM2). Credito immagine:Xue et al., Progressi scientifici, doi:10.1126/sciadv.abb7508
La foto di copertina del servizio online su Progressi scientifici questa settimana mostra l'imaging a fluorescenza con un mesoscopia computazionale in miniatura (CM 2 ). La tecnica dell'imaging a fluorescenza è uno strumento essenziale per biologi e neuroscienziati; però, i microscopi convenzionali e i microscopi miniaturizzati (miniscopi) sono vincolati da un prodotto con larghezza di banda limitata:una misurazione della capacità di informazione di un sistema ottico, profondità di campo ridotta e incapacità di risolvere emettitori distribuiti tridimensionali (3-D). Per superare i limiti esistenti, Yujia Xue e un team di ricercatori in ingegneria elettrica e informatica, biologia, neurofotonica e ingegneria biomedica presso la Boston University, NOI., ha sviluppato un mesoscope leggero e compatto noto come mesoscope in miniatura computazionale (CM 2 ).
La nuova piattaforma ha integrato una microlente per l'imaging e un array di LED per l'eccitazione all'interno della stessa configurazione. Il dispositivo ha eseguito l'imaging 3D a scatto singolo e ha facilitato un guadagno del campo visivo di 10 volte e un miglioramento della profondità di campo di 100 volte, rispetto ai miniscopi esistenti. Xue et al. ha testato il dispositivo con perline e fibre fluorescenti insieme a esperimenti fantasma per misurare gli effetti della dispersione di massa e della fluorescenza di fondo. Il team discute la praticità di questo mesoscope per ampie applicazioni in biomedicina e registrazione neurale 3D.
Microscopia a fluorescenza avanzata
La microscopia a fluorescenza è una tecnica chiave nella biologia fondamentale e nelle neuroscienze dei sistemi. I recenti sviluppi tecnologici mirano a superare le barriere di scala per studiare i singoli neuroni di pochi micron di dimensione. Per esempio, macroscopi, microscopi mesolens e microscopi a due fotoni hanno iniziato a colmare questa scala; però, lo sviluppo di tali sistemi di imaging è limitato dalle aberrazioni geometriche dipendenti dalla scala degli elementi ottici. Il campo visivo ottenibile (FOV) è inoltre limitato dalla ridotta profondità di campo del sistema in molte applicazioni di bioimaging. I ricercatori si stanno anche concentrando sulla miniaturizzazione della tecnologia per consentire l'imaging in vivo in animali che si comportano liberamente. Per esempio, microscopi miniaturizzati noti come "miniscopi" hanno ottenuto un accesso senza precedenti ai segnali neurali, sebbene i sistemi rimangano limitati dalla loro ottica, proprio come le loro controparti di microscopia a fluorescenza. Xue et al. ha quindi introdotto e dimostrato un microscopio computazionale in miniatura (CM 2 ) con grande scala, Misurazioni di fluorescenza 3-D su un compatto, piattaforma leggera.
Fluorescenza 3D a scatto singolo CM2. (A) Il CM2 combina un'ottica MLA e l'eccitazione dell'array di diodi emettitori di luce (LED) in una piattaforma compatta e leggera. (B) Immagine del prototipo CM2 (i cavi elettrici e il driver del sensore sono stati omessi). Credito fotografico:Yujia Xue, Università di Boston. (C) Misurazione CM2 su particelle fluorescenti da 100 μm sospese in resina trasparente. (D) Vista proiettata del volume ricostruito CM2 (7,0 mm per 7,3 mm per 2,5 mm) e tre regioni di ingrandimento con viste ortogonali. Barre della scala, 500 micron. CMOS, Semiconduttore complementare ossido di metallo. Credito:progressi scientifici, doi:10.1126/sciadv.abb7508 
Il team ha utilizzato un'ottica semplice nella configurazione per ottenere il miglioramento del prodotto della larghezza di banda spaziale (SBP) e le capacità di imaging 3D senza la necessità di scansione meccanica. La tecnica ha aggirato i limiti fisici dell'ottica integrata progettando congiuntamente l'hardware e l'algoritmo. Il CM 2 il metodo di imaging combinava diverse caratteristiche dell'imaging microscopico, come l'imaging integrale, microscopia a campo luminoso e imaging ad apertura codificata. Nel suo meccanismo d'azione, il microscopio ha raccolto una singola misurazione 2-D utilizzando un array di microlenti (MLA) per la successiva ricostruzione computazionale della distribuzione della fluorescenza 3-D.
Il CM 2 ha utilizzato l'array di microlenti come unico elemento di imaging e ha permesso alla configurazione di superare i limiti del campo visivo (FOV) imposti dalla lente dell'obiettivo dei microscopi convenzionali. Il CM 2 L'algoritmo ha risolto il problema della deconvoluzione da 2D a 3D per fornire ricostruzioni risolte in profondità. Xue et al. spiegato il principio del CM 2 capacità di imaging 3D a scatto singolo tracciando un'analogia con il multiplexing a divisione di frequenza (FDM). Il team ha quindi quantificato la risoluzione ottenibile del CM 2 calcolando la funzione di trasferimento di modulazione 3-D (MTF) del sistema e analizzando la risoluzione laterale.
Caratterizzazione del principio di imaging del CM2, varianza di spostamento, e risoluzione. (A) Il CM2 produce PSF array che variano assialmente per ottenere il sezionamento ottico. Il taglio assiale nei fuochi laterali è ben caratterizzato dal modello geometrico presentato nello studio. Il PCC delle PSF scansionate assialmente quantifica la risoluzione assiale prevista. EM, emissione. (B) L'MTF 3D (mostrato in scala logaritmica) mostra che CM2 acquisisce informazioni estese sulla frequenza assiale e ingrandisce l'SBP del sistema. Il supporto della MTF sperimentale corrisponde alla teoria (in una curva tratteggiata). L'angolo di ciascuna "banda" inclinata nell'MTF è impostato dalla posizione angolare della corrispondente microlente αMLA (in linea tratteggiata). (C) La varianza dello spostamento laterale è caratterizzata dal PCC delle PSF scansionate lateralmente. Il PSF nel FOV centrale (contrassegnato da linee di confine arancioni) contiene 3 × 3 fuochi; la PSF nel FOV esterno (contrassegnato da linee di confine blu) contiene 2 × 3 o 3 × 2 fuochi; il PSF nell'angolo FOV (contrassegnato da linee di confine gialle) contiene 2 × 2 fuochi. (D) La risoluzione in diverse regioni del FOV è caratterizzata dalla ricostruzione di un oggetto pinhole da 5 μm utilizzando il modello shift-invariant di CM2. L'intera larghezza laterale a metà del massimo (FWHM) è costantemente inferiore a 7 μm. Il FWHM assiale è ~ 139 μm nel FOV centrale e degrada a ~ 172 e ~ 189 μm nei FOV esterni e angolari, rispettivamente. (E) Geometria per l'imaging di un bersaglio fluorescente inclinato. (F) Misurazione CM2 grezza. (G) MIP del volume ricostruito (8,1 mm per 5,5 mm per 1,8 mm). Le caratteristiche 7-μm (gruppo 6, elemento 2) può essere risolto come mostrato nella proiezione xy zoom-in. La capacità di sezionamento assiale è caratterizzata dalla proiezione xz, convalidare la risoluzione assiale dipendente dalla dimensione della caratteristica. Credito:progressi scientifici, doi:10.1126/sciadv.abb7508 
Xue et al. approssimato la formazione dell'immagine del CM 2 configurazione utilizzando un modello shift-invariant slice-wise. Hanno caratterizzato la risoluzione e la varianza dello spostamento laterale della configurazione prima dell'imaging sperimentale e hanno ripreso un bersaglio con risoluzione fluorescente per convalidare la risoluzione laterale del CM 2 . Hanno convalidato le osservazioni utilizzando misurazioni simulate da Zemax per trovare un buon accordo tra le simulazioni e gli esperimenti. La nuova piattaforma ha permesso agli scienziati di localizzare emettitori fluorescenti distribuiti su un grande volume. Hanno testato le prestazioni di CM 2 su campioni con una dimensione caratteristica simile a un singolo neurone. Durante questi esperimenti, il CM 2 l'algoritmo era tollerante alle degradazioni del segnale come rapporti segnale-rumore ridotti per consentire un'alta qualità, ricostruzione a tutto campo. La squadra ha confrontato il CM 2 ricostruzione e uno stack assiale acquisito da una lente obiettiva per dimostrare l'accuratezza della localizzazione a colpo singolo delle singole particelle.
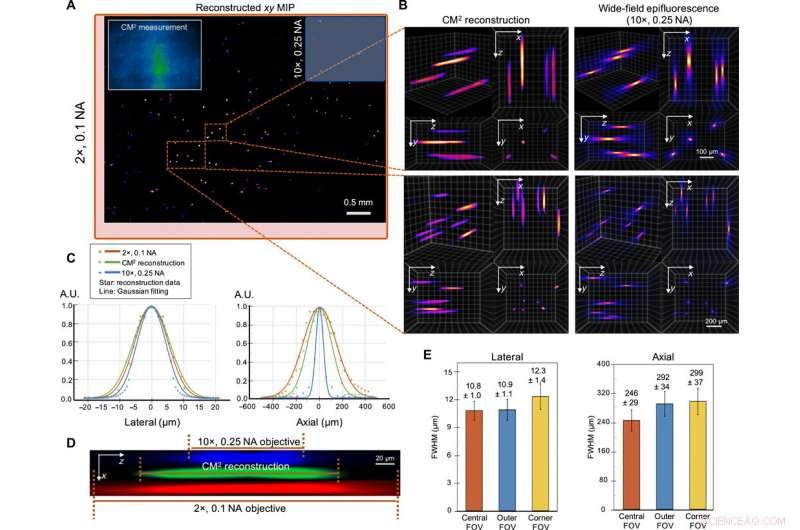
Imaging 3D a scatto singolo di particelle fluorescenti da 10 μm in un volume chiaro. (A) xy MIP del volume ricostruito che copre 5,7 mm per 6,0 mm per 1,0 mm. Riquadro in alto a sinistra:misurazione Raw CM2. Il FOV del CM2 è paragonabile a una lente dell'obiettivo 2 × (riquadro di delimitazione rosso) ed è ~ 25 × più largo dell'obiettivo dell'obiettivo 10 × (riquadro di selezione blu). (B) Zoom-in della ricostruzione 3D CM2 confrontata con lo stack assiale preso da un 10×, Obiettivo 0,25 NA. (C) Sezioni trasversali laterali e assiali della particella da 10 μm recuperata. Confrontando con le misurazioni della microscopia standard a fluorescenza ad ampio campo, il CM2 recupera fedelmente il profilo laterale della particella e realizza il sezionamento in profondità a colpo singolo. A.U., unità arbitrarie. (D) xz vista in sezione trasversale di una particella fluorescente ricostruita, rispetto allo stack assiale acquisito dagli obiettivi 2× e 10×. (E) Per caratterizzare le variazioni spaziali della ricostruzione, le statistiche delle FWHM laterali e assiali delle particelle ricostruite sono tracciate per il centrale, esterno, e angolo FOV. La larghezza laterale cambia solo leggermente (~0,9%) nel FOV esterno ma aumenta nell'angolo FOV (~13,9%). L'allungamento assiale degrada da ~ 246 μm nel FOV centrale a ~ 292 e ~ 299 μm nelle regioni FOV esterno e d'angolo, rispettivamente. Credito:progressi scientifici, doi:10.1126/sciadv.abb7508
Esperimenti su fibre fluorescenti su superficie curva e su fantasmi a diffusione controllata.
Gli scienziati hanno poi testato la capacità di visualizzare complessi campioni volumetrici fluorescenti su fibre fluorescenti sparse su una superficie curva stampata in 3D, imitando il profilo superficiale di una corteccia di topo, che copre un ampio campo visivo e una profondità estesa. L'algoritmo ha recuperato accuratamente le strutture a fuoco e ha risolto per l'oggetto 3-D, risolvendo la maggior parte delle singole fibre. Il team ha inoltre condotto esperimenti su otto fantasmi di imaging per testare le prestazioni di CM 2 in condizioni di dispersione di massa e forte fluorescenza di fondo. Durante gli esperimenti, hanno seminato tutti i fantasmi con la stessa concentrazione di particelle fluorescenti bersaglio e hanno attribuito le differenze nella ricostruzione alla diffusione di massa e alla fluorescenza di fondo. Il team ha quindi incluso particelle fluorescenti di fondo da 1,1 µm per imitare le sorgenti fluorescenti irrisolvibili comunemente osservate su campioni biologici; come i neutropili nel cervello. Hanno quantificato il livello di dispersione per ogni fantasma, eseguito la ricostruzione 3-D per ogni fantasma di dispersione ed eseguito tutte le deconvoluzioni utilizzando la stessa impostazione di calcolo. L'intervallo di profondità di ricostruzione stimato variava con le variazioni di superficie presenti in ciascun fantasma.

Ricostruzione di fibre fluorescenti. Il file del filmato visualizza la ricostruzione volumetrica di fibre fluorescenti su una superficie curva. Per confronto, la mappa di profondità stimata dallo stack focale da un microscopio a epifluorescenza a campo largo con un 2×, Viene visualizzata la lente dell'obiettivo 0,1 NA. Credito:progressi scientifici, doi:10.1126/sciadv.abb7508
In questo modo, Yujia Xue e colleghi hanno sviluppato un nuovo sistema di imaging a fluorescenza miniaturizzato per consentire l'imaging 3D mesoscopico a scatto singolo. Il mesoscopia computazionale in miniatura (CM 2 ) il metodo ha integrato l'imaging a fluorescenza e i moduli di eccitazione sulla stessa piattaforma compatta. Il team ha presentato le simulazioni e gli esperimenti per stabilire il meccanismo d'azione e la capacità di imaging 3D del CM 2 . Hanno simulato l'imaging a livello cerebrale delle reti vascolari ei risultati primari sono stati promettenti. Il CM 2 prototipo non è ancora paragonabile alle applicazioni in vivo montate sulla testa (su modelli animali) nei laboratori di neuroscienze, sebbene il team preveda di ottimizzare il dispositivo per l'imaging in vivo completamente corticale in topi che si muovono liberamente. Il dispositivo di imaging può essere ulteriormente migliorato con ulteriori sviluppi nell'hardware e negli algoritmi per aprire nuove ed entusiasmanti opportunità nell'ambito della registrazione neurale in vivo e delle applicazioni biomediche.
© 2020 Scienza X Rete