
Un campo di cellule di cancro alla prostata umano viene mostrato dopo l'esposizione a nanoparticelle di carbonio attivate dal laser. Le numerose cellule verdi hanno assunto un composto terapeutico modello, calceina, mentre le poche cellule rosse sono morte. Ciascuno dei punti verdi o rossi è una singola cella. Credito:Credito:Prerona Chakravarty
Usando "nanoblasti" chimici che praticano piccoli fori nelle membrane protettive delle cellule, i ricercatori hanno dimostrato una nuova tecnica per ottenere piccole molecole terapeutiche, proteine e DNA direttamente nelle cellule viventi.
Le nanoparticelle di carbonio attivate da esplosioni di luce laser innescano le minuscole esplosioni, che aprono fori nelle membrane cellulari il tempo necessario per far entrare gli agenti terapeutici contenuti nel fluido circostante. Regolando l'esposizione laser, i ricercatori hanno somministrato un composto marcatore di piccole molecole al 90% delle cellule bersaglio, mantenendo in vita più del 90% delle cellule.
La ricerca è stata sponsorizzata dal National Institutes of Health e dall'Institute of Paper Science and Technology della Georgia Tech. Se ne parlerà nel numero di agosto della rivista Nanotecnologia della natura .
"Questa tecnica potrebbe consentirci di fornire un'ampia varietà di terapie che ora non possono facilmente entrare nelle cellule, "ha detto Mark Prausnitz, un professore nella Scuola di Ingegneria Chimica e Biomolecolare presso il Georgia Institute of Technology. "Uno degli usi più significativi di questa tecnologia potrebbe essere per le terapie basate sui geni, che offrono grandi promesse in medicina, ma i cui progressi sono stati limitati dalla difficoltà di introdurre DNA e RNA nelle cellule".
Si ritiene che il lavoro sia il primo a utilizzare l'attivazione di nanoparticelle di carbonio reattive mediante laser per applicazioni mediche. Saranno necessarie ulteriori ricerche e studi clinici prima che la tecnica possa essere utilizzata negli esseri umani.
I ricercatori hanno cercato per decenni di guidare il DNA e l'RNA in modo più efficiente nelle cellule con una varietà di metodi, compreso l'uso di virus per trasportare materiali genetici nelle cellule, rivestendo DNA e RNA con agenti chimici o impiegando campi elettrici e ultrasuoni per aprire le membrane cellulari. Però, questi metodi precedenti hanno generalmente sofferto di bassa efficienza o problemi di sicurezza.
Con la loro nuova tecnica, che è stato ispirato da precedenti lavori sul cosiddetto "effetto fotoacustico, " Prausnitz e collaboratori Prerona Chakravarty, Wei Qian e Mostafa El-Sayed sperano di localizzare meglio l'applicazione di energia alle membrane cellulari, creare un approccio più sicuro ed efficiente per la somministrazione intracellulare di farmaci.
La loro tecnica inizia con l'introduzione di particelle di nerofumo di 25 nanometri - un milionesimo di pollice - di diametro nel fluido che circonda le cellule in cui devono essere introdotti gli agenti terapeutici. Lampi di luce nel vicino infrarosso da un laser a femotosecondi vengono quindi applicati al fluido a una velocità di 90 milioni di impulsi al secondo. Le nanoparticelle di carbonio assorbono la luce, che li rende caldi. Le particelle calde quindi riscaldano il fluido circostante per produrre vapore. Il vapore reagisce con le nanoparticelle di carbonio per formare idrogeno e monossido di carbonio.
I due gas formano una bolla che cresce man mano che il laser fornisce energia. La bolla collassa improvvisamente quando il laser viene spento, creando un'onda d'urto che perfora le membrane delle cellule vicine. Le aperture consentono agli agenti terapeutici del fluido circostante di entrare nelle cellule. I fori si chiudono rapidamente in modo che la cellula possa sopravvivere.
I ricercatori hanno dimostrato di poter ottenere la piccola molecola calceina, la proteina dell'albumina del siero bovino e il DNA plasmidico attraverso le membrane cellulari delle cellule di cancro alla prostata umane e delle cellule di gliosarcoma di ratto utilizzando questa tecnica. L'assorbimento di calcio è stato osservato nel 90% delle cellule a livelli laser che hanno lasciato in vita più del 90% delle cellule.
"Potremmo far sì che quasi tutte le cellule assorbano queste molecole che normalmente non entrerebbero nelle cellule, e quasi tutte le cellule sono rimaste vive, " disse Prerona Chakravarty, l'autore principale dello studio. "Il nostro sistema di nanoparticelle di carbonio attivato dal laser consente implosioni di bolle controllate che possono distruggere le membrane cellulari quanto basta per far entrare le molecole senza causare danni permanenti".
Per valutare per quanto tempo i fori nella membrana cellulare sono rimasti aperti, i ricercatori hanno lasciato la terapia simulata fuori dal fluido quando le cellule sono state esposte alla luce laser, quindi ha aggiunto gli agenti un secondo dopo aver spento il laser. Non hanno visto quasi nessun assorbimento delle molecole, suggerendo che le membrane cellulari si sono richiuse rapidamente.
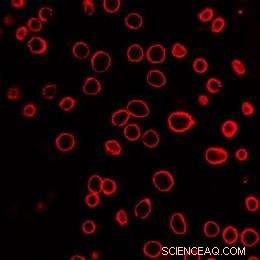
Un campo di cellule di cancro alla prostata umano viene mostrato dopo l'esposizione a nanoparticelle di carbonio attivate dal laser. Le membrane cellulari sono state colorate di rosso per facilitare la visualizzazione. Ciascuno dei cerchi rossi è una singola cella. Credito:Credito:Prerona Chakravarty
Per confermare che la reazione carbonio-vapore era un fattore critico che guidava i nanoblasti, i ricercatori hanno sostituito le nanoparticelle d'oro con le nanoparticelle di carbonio prima dell'esposizione alla luce laser. Poiché non avevano il carbonio necessario per la reazione, le nanoparticelle d'oro hanno prodotto poco assorbimento delle molecole, Prausnitz ha osservato.
Allo stesso modo, i ricercatori hanno sostituito i nanotubi di carbonio per le nanoparticelle di carbonio, e ha anche misurato poco assorbimento, che hanno spiegato notando che i nanotubi sono meno reattivi delle particelle di nerofumo.
La sperimentazione ha inoltre dimostrato che il DNA introdotto nelle cellule attraverso la tecnica attivata dal laser è rimasto funzionale e in grado di guidare l'espressione delle proteine. Quando il DNA plasmidico codificato per l'espressione della luciferasi è stato introdotto nelle cellule cancerose, la produzione di luciferasi è aumentata di 17 volte.
Per il futuro, i ricercatori hanno in programma di studiare l'uso di un laser a nanosecondi meno costoso per sostituire lo strumento a femtosecondi ultraveloce utilizzato nella ricerca. Hanno anche in programma di ottimizzare le nanoparticelle di carbonio in modo che quasi tutte vengano consumate durante l'esposizione alla luce laser. Le nanoparticelle di carbonio rimaste nel corpo non dovrebbero produrre effetti nocivi, anche se il corpo potrebbe non essere in grado di eliminarli, Prausnitz ha osservato.
"Questo è il primo studio che mostra la prova di principio per l'attivazione laser di nanoparticelle di carbonio reattive per la somministrazione di farmaci e geni, " ha detto. "C'è un lungo cammino da percorrere prima che questo possa essere portato in medicina, ma siamo ottimisti sul fatto che questo approccio possa in definitiva fornire una nuova alternativa per fornire agenti terapeutici nelle cellule in modo sicuro ed efficiente".