
Gli scienziati sono riusciti a registrare il potenziale elettrico attraverso la membrana delle cellule cardiache in contrazione (simbolo). Crediti:Keystone / Biblioteca fotografica scientifica / Beermedia / Fotolia / Montage
Per la prima volta, gli scienziati sono riusciti a registrare la corrente nei canali di membrana delle cellule cardiache in contrazione. Per fare questo, gli scienziati hanno combinato un microscopio a forza atomica con un metodo ampiamente utilizzato per misurare i segnali elettrici nelle cellule.
Gli impulsi elettrici svolgono un ruolo importante nelle cellule del corpo umano. Per esempio, i neuroni usano questi impulsi per trasmettere informazioni lungo i loro rami e il corpo li usa anche per controllare la contrazione dei muscoli. Gli impulsi vengono generati quando speciali proteine del canale si aprono nell'involucro esterno delle cellule, permettendo alle molecole cariche (ioni) di entrare o uscire dalla cellula. Queste proteine sono chiamate canali ionici. Dagli anni '70, è stato messo a disposizione dei ricercatori un metodo che consente di misurare l'attività di questi canali, ma fino ad ora questo metodo è stato utilizzato principalmente su cellule che non si muovono. Gli ingegneri elettrici dell'ETH di Zurigo e i biologi dell'Università di Berna hanno ora sviluppato ulteriormente il metodo, in modo che possano facilmente registrare l'attività delle cellule in movimento, come battere le cellule del muscolo cardiaco in un piatto di coltura tissutale.
Il metodo esistente prevede il posizionamento di una pipetta di vetro contro la membrana esterna di una cellula. L'apertura sulla punta della pipetta è così piccola che tocca solo una frazione della superficie cellulare. Idealmente, questo minuscolo lembo di membrana cellulare ha esattamente un canale ionico. L'interno della pipetta è riempito con un fluido conduttivo e un elettrodo, che permette di misurare le differenze di carica tra la parte esterna della cellula e l'interno della cellula (cioè un potenziale elettrico) e le variazioni temporanee di questo potenziale derivanti dall'attività nei canali ionici. Il metodo è indicato come tecnica patch-clamp perché la pipetta viene utilizzata per bloccare un cerotto della membrana cellulare.
Microscopio a forza atomica con ago per microiniezione
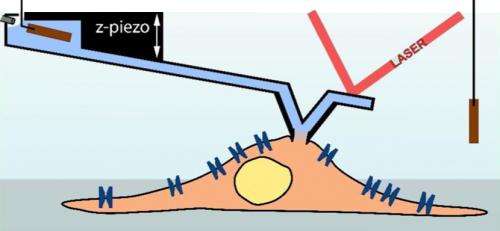
Un ago di registrazione del microscopio a forza atomica (azzurro) funge da pipetta per misurare una cellula (marrone chiaro; schema). (Illustrazione:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society) Un ago di registrazione del microscopio a forza atomica (azzurro) funge da pipetta per misurare una cellula (marrone chiaro; schema). Credito:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society
Guidato da Tomaso Zambelli, docente presso l'Istituto di ingegneria biomedica dell'ETH di Zurigo, e Hugues Abriel, professore presso il Dipartimento di ricerca clinica dell'Università di Berna, i ricercatori hanno ora combinato questa tecnica con un microscopio a forza atomica. Una punta del sensore è posizionata su un supporto mobile - un cosiddetto cantilever - per scansionare la superficie dell'oggetto microscopico. Diversi anni fa, i ricercatori sono riusciti a produrre punte del sensore con un canale interno, che consente l'iniezione controllata da un computer di molecole in una cellula. Questa tecnica è ora commercializzata dallo spin-off dell'ETH Cytosurge. Però, gli scienziati hanno continuato lo sviluppo di questa tecnica inserendo nell'ago per microiniezione un elettrodo per eseguire misurazioni di patch-clamp. I ricercatori hanno ora pubblicato i risultati positivi di questa impresa sulla rivista Nano lettere .
La tecnica del patch-clamp non è solo un metodo centrale per la ricerca di base in biologia cellulare, è anche usato di routine nello sviluppo di nuovi farmaci. Per esempio, l'industria farmaceutica è legalmente richiesta come parte del processo di approvazione per i nuovi farmaci per testare se questi farmaci interagiscono con i canali ionici. Un farmaco che blocca i canali ionici può causare grave aritmia cardiaca nei pazienti, che dovrebbe essere evitato a tutti i costi.
Possibilità di misurazioni e automazione più lunghe
Nel caso della tecnica convenzionale del patch-clamp, un operatore posiziona manualmente la pipetta contro la cella; sebbene esistano procedure automatizzate, le loro applicazioni sono limitate. Così, le cellule in esame devono avere le stesse dimensioni e forma e non devono muoversi (come fanno le cellule cardiache).
Nel caso del nuovo metodo, il microago è controllato da un computer che utilizza misurazioni di forza dal microscopio a forza atomica per tenerlo a una breve distanza costante dalla superficie cellulare. "Questo rende il contatto tra l'ago e la cella molto più stabile, che ci consente di effettuare misurazioni per un periodo di tempo più lungo e persino di testare celle in movimento, " spiega Zambelli. Per la prima volta, i ricercatori sono così riusciti a misurare i cambiamenti del potenziale elettrico nei canali ionici delle cellule cardiache battenti. Zambelli dice che può anche immaginare di usarlo come base per lo sviluppo di un metodo automatizzato per testare qualsiasi cellula, indipendentemente dalla sua forma o dimensione.