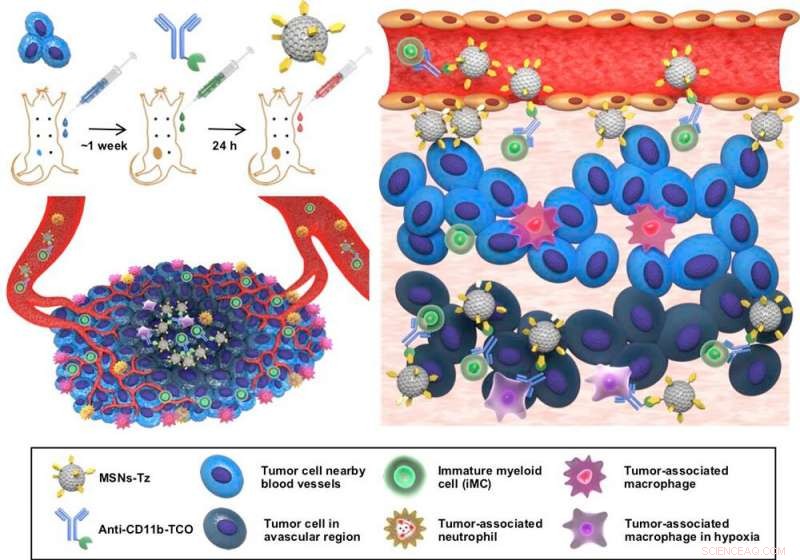
Figura 1:Una rappresentazione schematica della strategia di targeting delle cellule immunitarie assistite dalla reazione di clic (CRAIT) utilizzata per migliorare la penetrazione del tumore delle NP caricate di farmaco. (sinistra, top) Gli anticorpi vengono pre-iniettati per marcare le cellule immunitarie circolanti, e le nanoparticelle caricate con il farmaco vengono successivamente somministrate per colpire le cellule immunitarie tramite la reazione di clic. (sinistra, in basso) Illustrazione schematica del microambiente tumorale caratterizzato dal reclutamento di cellule infiammatorie e dalla distribuzione disomogenea dei vasi sanguigni. (a destra) Illustrazione schematica sui principi della strategia CRAIT. Le cellule immunitarie sono etichettate da anticorpi e successivamente etichettate con nanoparticelle mediante una reazione di clic. Le cellule marcate trasportano nanoparticelle dalla periferia del tumore all'interno del tumore. Credito:IBS
Gli scienziati dell'IBS hanno segnalato una nuova strategia di targeting che consente la penetrazione profonda del tumore delle nanoparticelle caricate con il farmaco. Hanno indotto il collegamento di anticorpi diretti contro le cellule immunitarie a nanoparticelle caricate di farmaco sulle cellule, invece di assorbirli nelle cellule o utilizzare coniugati anticorpo-nanoparticella.
Piccoli nanobot che scorrono attraverso il corpo per riparare le cellule danneggiate. Una volta doveva essere considerato fantascienza, questi microrobot stanno diventando una realtà con una sfilza di prove sperimentali. Generalmente si pensa che le nanoparticelle siano così piccole da poter vagare liberamente per tutto il corpo dopo la somministrazione. Però, questo è vero solo in parte. In un tumore, le nanoparticelle possono penetrare nei tumori solo a una profondità di 100 µm dai vasi. La diffusione delle nanoparticelle può essere ostacolata anche da numerose barriere, come tessuto tumorale denso, alta pressione interstiziale, e distribuzione vascolare disomogenea. Così, le cellule tumorali situate in profondità nel tessuto possono sopravvivere, con conseguente recidiva.
interessante, è stato riferito che le cellule immunitarie tendono ad accumularsi nei tumori profondi. Quando i tumori superano l'afflusso di sangue, le cellule immunitarie vengono reclutate preferibilmente in un microambiente tumorale per supportare l'afflusso di sangue ai tumori e il rimodellamento dei tessuti. Ci sono stati diversi tentativi di utilizzare le cellule immunitarie per fornire farmaci antitumorali alle regioni inaccessibili dagli approcci di targeting convenzionali. Poiché la maggior parte di essi richiede lunghe manipolazioni per l'estrazione, crescere, e iniettare cellule, questo processo ex vivo riduce l'efficacia del trattamento. Altri hanno esplorato modi per far sì che gli anticorpi che trasportano nanoparticelle colpiscano le cellule immunitarie. Ancora, questo approccio si dimostra inefficace poiché le nanoparticelle si accumulano con il farmaco chemioterapico trasportato e non possono raggiungere le designazioni in modo efficiente.
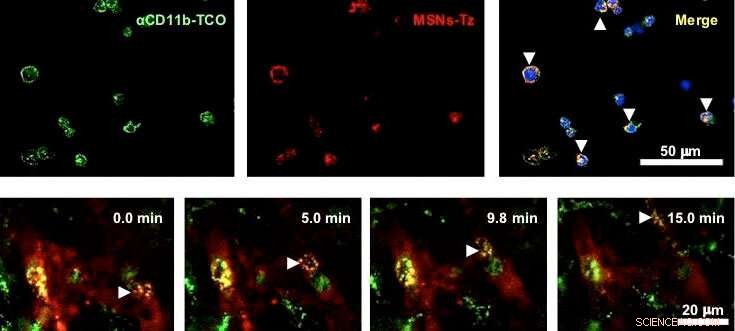
Figura 2:(in alto) Valutazione in vitro della reazione click tra anticorpi (verde) e nanoparticelle (rosso) su cellule immunitarie. (in basso) Le cellule immunitarie che trasportano nanoparticelle migrano nei vasi sanguigni. Le frecce bianche indicano le cellule immunitarie gialle poiché sono contrassegnate con anticorpi (verde) e nanoparticelle (rosso). Credito:IBS
In un articolo pubblicato su Giornale della Società Chimica Americana , il gruppo di ricerca congiunto guidato dal direttore Taeghwan Hyeon presso il Center for Nanoparticles all'interno dell'Institute for Basic Science (IBS) a Daejeon, Dr. Seung-Hae Kwon presso il Korea Basic Science Institute di Seoul, e il Prof. Nohyun Lee alla Kookmin University di Seoul, La Corea del Sud ha riportato una nuova strategia di targeting che consente la penetrazione profonda del tumore delle nanoparticelle caricate con il farmaco. Hanno usato una "reazione al clic, " una reazione chimica che unisce facilmente i blocchi molecolari proprio come due pezzi di una cintura di sicurezza "click" per allacciarsi. "La nostra idea era di indurre il collegamento di anticorpi diretti contro le cellule immunitarie a nanoparticelle caricate di farmaci sulle cellule, invece di assorbirli nelle cellule o utilizzare coniugati anticorpo-nanoparticella. La maggior parte degli altri studi lo ha fatto e non è riuscito a produrre risultati soddisfacenti, " nota il professor Nohyun Lee, il corrispondente autore dello studio.
In una reazione di clic, i reagenti chimici consentono un facile collegamento di gruppi chimici innaturali a qualsiasi sito di una proteina bersaglio con un'elevata selettività del sito. Nello studio, i ricercatori hanno utilizzato la reazione clic tra trans-cicloottene e tetrazina. Gli anticorpi funzionalizzati al trans-cicloottene vengono iniettati nei topi per marcare le cellule immunitarie infiltranti il tumore. Dopo un certo tempo, nanoparticelle di silice mesoporosa funzionalizzate con tetrazina vengono somministrate in modo che "scattino" per collegarsi alle cellule immunitarie. "Questa strategia di targeting delle cellule immunitarie assistite dalla reazione di clic (CRAIT) ha "invaso" con successo le aree previste:l'imaging a fluorescenza in tempo reale del tessuto tumorale mostra che le cellule immunitarie mobili trasportano le nanoparticelle come mostrato nella Figura 2. Rispetto al targeting passivo, il metodo CRAIT ha portato a una doppia riduzione del carico tumorale nei modelli aggressivi di cancro al seno, " spiega il dottor Soo Hong Lee, il primo autore dello studio. Le nanoparticelle caricate con un farmaco antitumorale, doxorubicina, non ha influenzato la vitalità e la migrazione delle cellule.
Direttore Taeghwan Hyeon, l'autore corrispondente dello studio dice, "La distribuzione intratumorale delle nanoparticelle fornite dal metodo CRAIT è stata la chiave per superare i limiti dei metodi di consegna convenzionali. Questo studio amplierà l'applicazione delle nanomedicine".
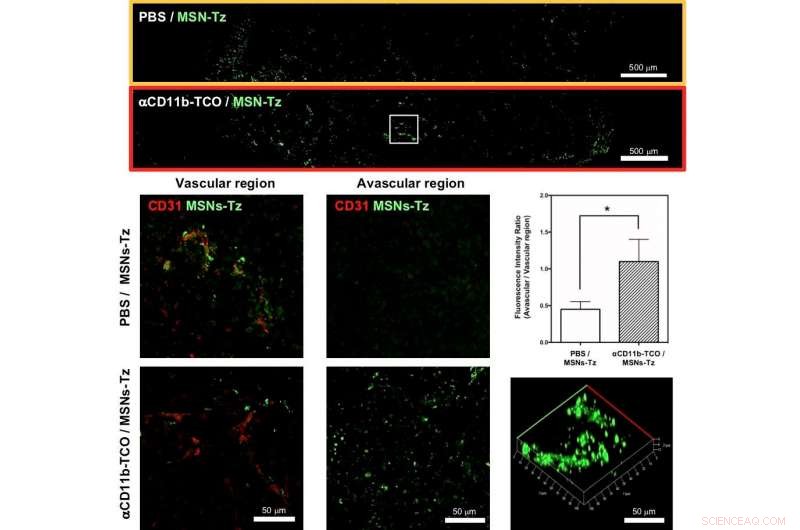
Figura 3:(in alto) Sezioni di tumori rappresentative selezionate per mostrare la distribuzione delle nanoparticelle nel gruppo non mirato (riquadro arancione) e nel gruppo CRAIT (riquadro rosso). (al centro e in basso, a sinistra e al centro) Distribuzione intratumorale del gruppo non mirato (al centro) e del gruppo CRAIT (in basso) nella regione vascolare (a sinistra) e nella regione avascolare (al centro). (Giusto, al centro) Rapporto tra vascolare e regione del gruppo non mirato e del gruppo CRAIT. (Giusto, in basso) Immagine al microscopio tridimensionale della sezione tumorale. Credito:IBS
Poiché il metodo CRAIT si basa sulla reazione al clic, può essere applicato a vari veicoli di consegna tra cui micelle, liposomi, e altre nanoparticelle. Inoltre, se sono disponibili anticorpi adeguati, varie celle circolanti possono essere utilizzate come veicoli di consegna. Poiché le cellule circolanti sono coinvolte in varie malattie infiammatorie, la copertura del metodo CRAIT non si limita al cancro. Il versatile metodo CRAIT è semplice, che richiede la modifica di anticorpi e nanoparticelle utilizzando una reazione di bioconiugazione ben sviluppata.