Le gabbie proteiche trovate all'interno dei microbi aiutano il loro contenuto a resistere al duro ambiente intracellulare, un'osservazione che ha molte applicazioni di bioingegneria. I ricercatori della Tokyo Tech hanno recentemente sviluppato un approccio innovativo di bioingegneria che utilizza batteri geneticamente modificati per incorporare gabbie proteiche attorno ai cristalli proteici. Questo metodo di biosintesi intracellulare produce in modo efficiente complessi proteici altamente personalizzati, che potrebbero trovare applicazioni come catalizzatori solidi avanzati e nanomateriali funzionalizzati.
In natura, le proteine possono assemblarsi per formare complessi organizzati con una miriade di forme e scopi. Grazie ai notevoli progressi compiuti dalla bioingegneria negli ultimi decenni, gli scienziati possono ora produrre complessi proteici personalizzati per applicazioni specializzate. Ad esempio, le gabbie proteiche possono confinare gli enzimi che agiscono come catalizzatori per una reazione chimica mirata. Allo stesso modo, i cristalli proteici, strutture composte da unità ripetitive di proteine, possono fungere da impalcature per sintetizzare materiali solidi con terminali funzionali esposti.
Tuttavia, incorporare (o "incapsulare") proteine estranee sulla superficie di un cristallo proteico è impegnativo. Pertanto, la sintesi di cristalli proteici che incapsulano gruppi proteici estranei è stata difficile. Finora non esistono metodi efficienti per raggiungere questo obiettivo e i tipi di cristalli proteici prodotti sono limitati. E se la risposta fosse il macchinario cellulare batterico?
In uno studio recente, un gruppo di ricerca del Tokyo Institute of Technology, tra cui il professor Takafumi Ueno, ha segnalato un nuovo metodo in-cell per incapsulare gabbie proteiche con diverse funzioni su cristalli proteici. Il loro articolo, pubblicato su Nano Letters , rappresenta un progresso sostanziale nell'ingegneria dei cristalli proteici.
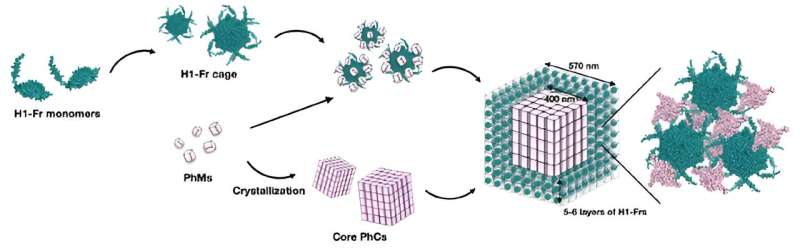
La strategia del team prevede la modifica genetica dei batteri Escherichia coli per produrre due elementi costitutivi principali:monomero poliedrico (PhM) e ferritina modificata (Fr). Da un lato, i PhM si combinano naturalmente all'interno delle cellule per formare un cristallo proteico ben studiato chiamato cristallo di poliedri (PhC). D'altra parte, è noto che le unità da 24 Fr si combinano per formare una gabbia proteica stabile.
"La ferritina è stata ampiamente utilizzata come modello per costruire bio-nanomateriali modificandone le superfici interne ed esterne. Pertanto, se la formazione di una gabbia Fr e la sua successiva immobilizzazione su PhC possono essere eseguite simultaneamente in una singola cellula, le applicazioni di i cristalli proteici all'interno delle cellule verranno espansi come materiali bioibridi," spiega il prof. Ueno.
Per immobilizzare le gabbie Fr in PhC, i ricercatori hanno modificato il gene che codifica per Fr per includere un tag α-elica (H1) di PhM, creando così H1-Fr. Il ragionamento alla base di questo approccio è che le eliche H1 naturalmente presenti nelle molecole PhM interagiscono in modo significativo con i tag su H1-Fr, agendo come "agenti di reclutamento" che legano le proteine estranee al cristallo.
Utilizzando tecniche microscopiche e analitiche avanzate e chimiche, il team di ricerca ha verificato la validità dell'approccio proposto. Attraverso vari esperimenti, hanno scoperto che i cristalli risultanti avevano una struttura nucleo-guscio, vale a dire un nucleo cubico PhC largo circa 400 nanometri ricoperto da cinque o sei strati di gabbie H1-Fr.
Questa strategia per la biosintesi di cristalli proteici funzionali è molto promettente per applicazioni in medicina, catalisi e ingegneria dei biomateriali. "Le gabbie H1-Fr hanno il potenziale per immobilizzare le molecole esterne al loro interno per il rilascio molecolare", afferma il prof. Ueno.
"I nostri risultati indicano che le strutture nucleo-guscio H1-Fr/PhC, che mostrano gabbie H1-Fr sulla superficie esterna del nucleo PhC, possono essere controllate individualmente a livello nanometrico. Accumulando diverse molecole funzionali nel nucleo PhC e H1 -In una gabbia, è possibile costruire cristalli gerarchici controllati su scala nanometrica per applicazioni biotecnologiche avanzate."
I lavori futuri in questo campo ci aiuteranno a realizzare il vero potenziale dei cristalli e degli assemblaggi proteici della bioingegneria. Con un po' di fortuna, questi sforzi apriranno la strada a un futuro più sano e sostenibile.
Ulteriori informazioni: Thuc Toan Pham et al, Visualizzazione di una gabbia proteica su un cristallo proteico mediante In-Cell Crystal Engineering, Nano Letters (2023). DOI:10.1021/acs.nanolett.3c02117
Fornito dal Tokyo Institute of Technology