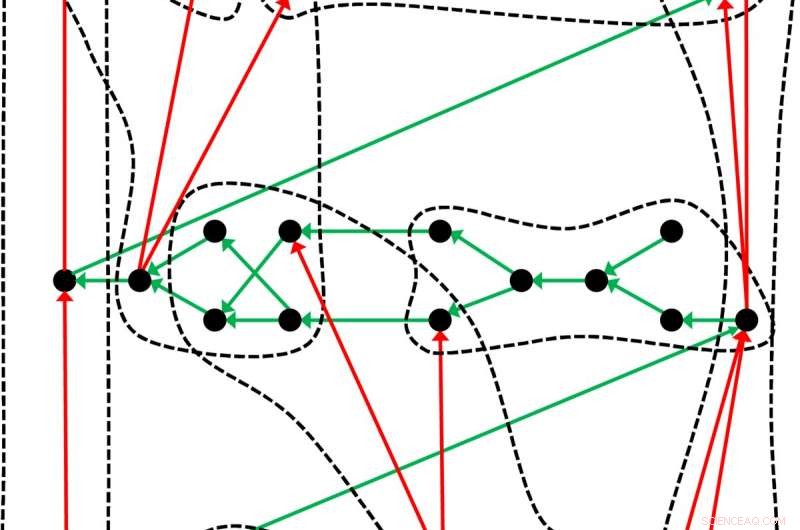
Una tavola periodica leggermente diversa:la tavola degli elementi chimici, che risale a Dmitri Mendeleev e Lothar Meyer, è solo un esempio di come gli oggetti – in questo caso gli elementi chimici – possono essere organizzati in un tale sistema. I ricercatori di Lipsia illustrano la struttura generale di una tavola periodica con questo esempio:i punti neri rappresentano gli oggetti ordinati dalle frecce verdi. Utilizzando un criterio appropriato, gli oggetti possono essere classificati in gruppi (linee tratteggiate) in cui le frecce rosse creano un sottordine. Credito:Guillermo Restrepo, MPI per la matematica nelle scienze
La tavola periodica degli elementi rappresentata dalla maggior parte dei libri di chimica è solo un caso speciale. Questa panoramica tabellare degli elementi chimici, che risale a Dmitri Mendeleev e Lothar Meyer e agli approcci di altri chimici per organizzare gli elementi, comportano diverse forme di rappresentazione di una struttura nascosta degli elementi chimici. Questa è la conclusione raggiunta dai ricercatori del Max Planck Institute for Mathematics in the Sciences di Lipsia e dell'Università di Lipsia in un recente articolo. L'approccio matematico degli scienziati di Lipsia è molto generale e può fornire molti diversi sistemi periodici a seconda del principio di ordine e classificazione, non solo per la chimica, ma anche per molti altri campi del sapere.
È un'icona delle scienze naturali ed è appesa nella maggior parte delle aule di chimica:la tavola periodica degli elementi, che quest'anno festeggia i 150 anni. La panoramica tabellare è strettamente legata a Dmitri Mendeleev e Lothar Meyer, due ricercatori che, nel 1860, ha creato una disposizione di elementi basata sulle loro masse atomiche e somiglianze. Oggi sono ordinati per numero atomico (che indica il numero di protoni nel nucleo atomico) dall'idrogeno leggero (un protone) all'oganesson sintetico (118 protoni). Gli elementi sono anche classificati in gruppi:gli atomi nella stessa colonna di solito hanno lo stesso numero di elettroni nel loro guscio esterno.
Tavola periodica in diverse varianti
A prima vista, la tavola periodica sembra aver portato un ordine univoco e definitivo ai 118 elementi attualmente conosciuti. Ma le apparenze possono ingannare perché molte cose rimangono ancora controverse:gli scienziati non sono d'accordo su quali elementi appartengano esattamente al terzo gruppo sotto lo scandio e l'ittrio. Per esempio, la posizione corretta di lantanio e attinio è dibattuta. Se uno guarda più da vicino, si scopriranno varianti leggermente diverse della tavola periodica nelle aule, aule, e libri di testo.
Guillermo Restrepo e Wilmer Leal del Max Planck Institute for Mathematics in the Sciences e dell'Università di Lipsia non sono sorpresi. Per loro, non esiste una disposizione degli elementi univocamente corretta; a seconda del criterio applicato per la classificazione, risulta una tavola periodica diversa. Gli atomi possono essere suddivisi in base alla configurazione elettronica (cioè il numero e la disposizione dei loro elettroni), il loro comportamento chimico, la loro solubilità, o la loro presenza in depositi geologici. È ormai ampiamente accettato che gli elementi chimici debbano essere disposti in base al loro numero atomico e divisi in gruppi in base alla loro configurazione elettronica. Ma anche per questa tavola periodica, esistono numerose e diverse forme di rappresentazione. Ad esempio:come una spirale con vari rigonfiamenti, piramidale, o come un fiore tridimensionale.
Una struttura comune dietro le tavole periodiche
Guillermo Restrepo e Wilmer Leal hanno ora studiato sistematicamente l'ambiguità della tavola periodica. Ciò ha portato a scoperte che sono di notevole importanza anche al di là della chimica. Di conseguenza, tutte le forme di rappresentazione degli elementi chimici si basano su una struttura comune, che i matematici chiamano ipergrafo ordinato. La venerabile tavola periodica di Mendeleev e Meyer offre quindi solo una rappresentazione della struttura generale, che ora postulano Guillermo Restrepo e Wilmer Leal. Da ciò possono derivare in qualsiasi momento anche nuove disposizioni. Guillermo Restrepo confronta quindi l'ordine degli elementi chimici con una scultura su cui la luce cade da direzioni diverse. "Le varie ombre che la figura proietta sono le tavole periodiche. Ecco perché ci sono così tanti modi per creare queste tavole. In un certo senso, le tavole del periodo sono proiezioni. Proiezioni della struttura interna della tavola periodica."
Gli scienziati di Lipsia stanno ora cercando di determinare la struttura matematica nascosta su cui si basano le note tavole periodiche della chimica. Per ora, hanno definito tre condizioni che devono essere soddisfatte per stabilire una tavola periodica. Primo, ci vogliono oggetti che devono essere ordinati. Per Mendeleev, Meyer e i creatori delle altre tavole periodiche note della chimica, questi sono gli elementi chimici. These objects must be arranged according to some properties such as the atomic mass or the atomic number (i.e. the number of protons). Finalmente, one criterion is required to group the objects in classes. Mendeleev and Meyer used the chemical similarity for this.

A periodic table of chemical bonds:Each of the 94 circles with chemical element symbols represents the bond that the respective element forms with an organic residue. The bonds are ordered according to how strongly they are polarized. Where there is a direct arrow connection, the order is clear:Bonds of hydrogen, Per esempio, are more polarized than bonds of boron, fosforo, and palladium. The same applies to rubidium in comparison to caesium, which has particularly low polarized bonds and is therefore at the bottom of the new periodic table. If there is no direct arrow between two elements, they may still be comparable – if there is a chain of arrows between them. Per esempio, the bonds of oxygen are more polarized than the bonds of bromine. Bonds represented by the same colour have the same binding behaviour and belong to one of the 44 classes. Credit:Guillermo Restrepo, MPI for Mathematics in the Sciences
Periodic table of chemical bonds
"If these three conditions are met, periodic tables can also be created for other chemical objects and even for objects outside chemistry, " says Guillermo Restrepo. He and Wilmer Leal show this by looking at the chemical bonds between atoms of 94 elements and different conjugates. The polarizability of 94 single-covalent bonds, where bonds are arranged according to the electronegativity and atomic radius of one of the bonded atoms. Per esempio, fluoro, chlorine, or oxygen are highly electronegative and assume relatively small atomic radii in compounds. The bonds are then classified based on how much they resemble each other.
"We have investigated almost 5, 000 substances consisting of two elements in different proportions, " explains Guillermo Restrepo. "We then looked for similarities within this data. Per esempio, sodium and lithium are similar because they combine with the same elements in the same proportions (e.g. with oxygen or chlorine, bromo, and iodine). We thus found patterns we can use to classify the elements."
A periodic table as a network instead of a matrix
In the 44 classes of chemical elements, there are some similarities with the main groups of Mendeleev's and Meyer's periodic table. Per esempio, the alkali metals sodium and lithium are found in one group because they form the same simple salts with halogens such as chlorine or fluorine. Like the elements themselves, the bonds of the four halogens (fluorine, chlorine bromine, and iodine) are also found in the same group. Però, there are also classifications that differ significantly from those in the conventional periodic table. Per esempio, carbon and silicon are no longer in the same class because they form very different compounds.
The representation of the periodic table of chemical bonds also has nothing to do with the familiar matrix-like arrangement of the classical periodic tables of the elements. Anziché, the 94 covalent bonds are represented in a network of differently colored circles. Each circle represents a chemical bond, and the colou symbolizes belonging to one of the 44 groups. Because now two criteria are used for the sorting, there is no longer any clear order of the atoms (like in the tables of Mendeleev and Meyer)—mathematicians speak of a partial order. The circles are therefore connected to other circles by one or more arrows, thereby creating an ordered hypergraph.
Periodic tables in other scientific fields
The chemical elements and their compounds can also be represented in completely different periodic tables—depending on the underlying order and classification principle. What's more:The objects of numerous other scientific fields and their applications can also be arranged in periodic tables. Per esempio, ordered hypergraphs are used in information systems and web mining. Possible periodic systems also emerge when countries are considered; these can be classified according to social or economic indicators as well as geographical proximity or cultural similarity. Other examples can be found in engineering, environmental sciences, sociologia, and many other disciplines. The scientists not only study periodic systems because of their importance for chemistry, ma, soprattutto, because of their applications in many other disciplines.