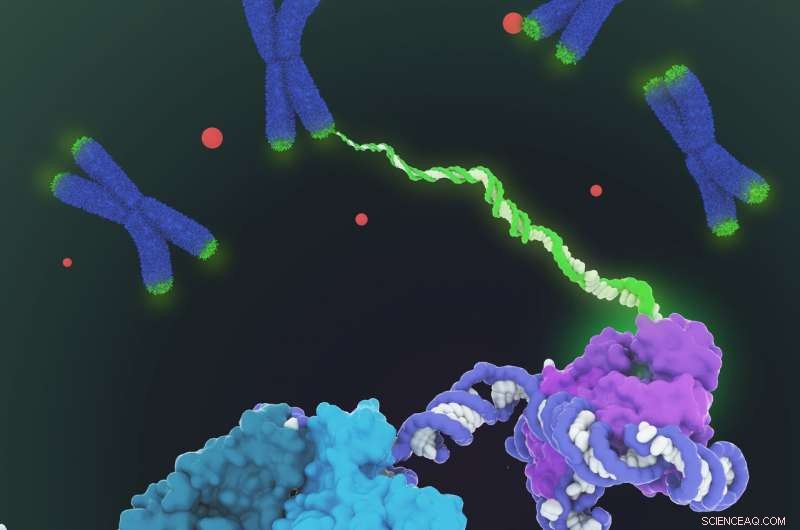
Viene mostrato il modello di riempimento dello spazio della struttura dell'oloenzima della telomerasi umana determinata mediante microscopia crioelettronica (crio-EM). La telomerasi catalizza la sintesi del DNA telomerico (verde) alle estremità dei cromosomi (blu) per compensare la perdita di telomeri durante la replicazione del genoma. La struttura comprende due lobi con funzionalità distinte:il nucleo catalitico (viola) responsabile della sintesi del DNA e un lobo ribonucleoproteico H/ACA (ciano, verde acqua e verde chiaro) importanti per la biogenesi e la localizzazione della telomerasi nel corpo di Cajal (punti rossi e in basso a sinistra in primo piano). Dato che la regolazione della telomerasi è implicata nel cancro e nell'invecchiamento, questa prima visualizzazione architettonica della telomerasi umana rappresenta un importante passo avanti nel campo della telomerasi e nella progettazione terapeutica basata sulla telomerasi. Credito:Janet Iwasa
Più di 30 anni fa, quando l'Università della California, I ricercatori di Berkeley hanno scoperto la telomerasi, un enzima che allunga le estremità dei cromosomi e impedisce loro di sfilacciarsi abbastanza da uccidere una cellula, le speculazioni si sono scatenate sul suo ruolo nell'invecchiamento e nel cancro, scatenando una pressa a tutto campo per produrre farmaci per attivare o bloccare l'enzima.
Sebbene né i farmaci antietà a base di telomerasi, propagandato come una "fontana della giovinezza, "né farmaci antitumorali sono ancora comparsi, la pubblicazione oggi da parte degli scienziati dell'UC Berkeley del primo quadro dettagliato della struttura molecolare della telomerasi umana dovrebbe far ripartire questo sforzo, consentendo screening farmacologici più mirati e una progettazione intelligente di nuovi farmaci.
"È passato molto tempo. Ci è voluta molta perseveranza, " ha detto Kathleen Collins, un professore di biologia molecolare e cellulare dell'UC Berkeley che ha lavorato sull'enzima per 26 anni.
Collins ed Eva Nogales, anche professore di biologia molecolare e cellulare, sono gli autori senior di un articolo che descrive la struttura molecolare 3-D dell'enzima telomerasi umana pubblicato questa settimana sulla rivista Natura .
Un collo di bottiglia è stato ottenere campioni puri di questa complessa molecola, che è composto da uno scheletro di RNA decorato da sei tipi di proteine che si muovono mentre aggiungono DNA alle estremità dei cromosomi. I laboratori di tutto il mondo hanno discusso se l'enzima operi da solo o come gemelli siamesi, e come e quante proteine decorano la spina dorsale dell'RNA.
Senza consenso su queste domande, si è dimostrato difficile progettare un farmaco per colpire la macchina molecolare e distruggere l'attività della telomerasi, che potrebbe fermare un cancro che ha aumentato i suoi livelli di telomerasi, o riavviare la telomerasi, forse per preparare il corpo a una rapida divisione cellulare dopo un trapianto di midollo osseo.
La struttura appena rivelata manca ancora di dettagli precisi, ma combinato con la conoscenza della sequenza genica della telomerasi umana, fornisce informazioni sufficienti per iniziare a pensare a potenziali bersagli per i farmaci, ha detto il primo autore Thi Hoang Duong "Kelly" Nguyen, un borsista post-dottorato del Miller Institute presso l'UC Berkeley.
"Le migliori immagini precedenti della telomerasi umana avevano una risoluzione di soli 30 Ångstrom; siamo stati in grado di ottenere una risoluzione di circa 7-8 ngstrom utilizzando la microscopia crioelettronica, " ha detto Kelly. "Quando sono arrivato al punto in cui potevo vedere tutte le subunità - avevamo 11 subunità proteiche in totale - è stato un momento di, 'Oh, Oh, questo è il modo in cui si adattano tutti insieme.'"
Nguyen, Collins e Nogales stanno lavorando attivamente per migliorare la risoluzione a 3 o 4 Ångstrom, circa la dimensione di due atomi di carbonio, che è sufficiente per la progettazione di farmaci.
La telomerasi riempie i telomeri
I telomeri sono stati rilevati per la prima volta a livello molecolare alla fine degli anni '70 da Elizabeth Blackburn, poi all'UC Berkeley e ora presidente emerita del Salk Institute for Biological Studies di La Jolla, California. Lavorando con il protozoo ciliato Tetrahymena, lei e colleghi hanno dimostrato che le estremità dei cromosomi sono ricoperte da sequenze ripetute di DNA. Armato della conoscenza della sequenza dei telomeri, i ricercatori hanno poi dimostrato che i telomeri nei tessuti degli organismi multicellulari si accorciano ogni volta che una cellula si divide. I telomeri proteggono i filamenti di DNA dallo sfilacciamento e dal danneggiamento alle estremità, proprio come la punta di plastica all'estremità di un laccio. Si pensa che il fatto che scendano ad ogni divisione cellulare ci protegga dal cancro, quando una cellula viene dirottata e prolifera continuamente.
Nel 1985 all'UC Berkeley, Blackburn e l'allora studentessa Carol Greider scoprirono la telomerasi, un enzima che aggiunge il DNA alle estremità dei cromosomi, allungandoli e allungando la vita della cellula. Blackburn, Greider e un altro collega, Jack Szosak, condiviso il Premio Nobel 2009 in Fisiologia o Medicina per la scoperta della telomerasi.
Da allora gli scienziati hanno scoperto che, nell'uomo e in altri organismi pluricellulari, la telomerasi è espressa solo nell'embrione, non nella maggior parte delle cellule adulte. Ciò significa che la maggior parte delle cellule alla nascita ha una capacità predeterminata di crescere e dividersi, dopo di che muoiono. Molti scienziati ritengono che i telomeri impoveriti siano una delle principali cause dell'invecchiamento.
Collins ha cercato di determinare la struttura della telomerasi sin da quando è stata scoperta la prima proteina telomerasi umana nel 1997, e lei e i suoi colleghi hanno scoperto e caratterizzato ampiamente molte delle proteine nel grande enzima, così come la struttura a forcina spezzata della spina dorsale dell'RNA della telomerasi. Tuttavia, il modo in cui si adattavano tutti insieme era un enigma a causa dei risultati contrastanti di molti laboratori diversi.
Nguyen è stato in grado di isolare l'enzima attivo e purificarlo molto meglio di chiunque altro prima, e ha assunto un nuovo, microscopio crioelettronico all'avanguardia per determinare in modo univoco la struttura della telomerasi attiva. Cryo-EM è una tecnica per determinare le strutture molecolari di composti che non possono essere cristallizzati e ripresi con i raggi X, e i suoi sviluppatori hanno vinto il Premio Nobel 2017 per la Chimica.
Una volta che il team dell'UC Berkeley ebbe la struttura, Nguyen ha detto, è diventato chiaro perché le mutazioni genetiche in alcune delle proteine della telomerasi interferiscono con l'enzima causando la malattia. Nel 1999, Collins ha scoperto la prima malattia umana conosciuta causata da una mutazione della telomerasi:una mutazione in una proteina della telomerasi chiamata dyskerin che è responsabile di una malattia rara chiamata dyskeratosis congenita. I pazienti sviluppano anemia e problemi alla pelle e all'intestino, e più frequentemente muoiono per insufficienza midollare.
La ragione, Collins dice, è che ci sono due molecole di discherina legate alla spina dorsale dell'RNA che non solo devono raggiungere la rete di altre proteine ma anche toccarsi l'una con l'altra, e le mutazioni che causano malattie impediscono questi collegamenti, paralizzare la capacità della spina dorsale dell'RNA di sopravvivere nelle cellule. Alcuni bambini con discheratosi congenita hanno livelli di telomerasi circa il 25% del normale e una durata della vita inferiore a due decenni. Quelli con la metà del livello normale di telomerasi in genere raggiungono una crisi di salute nella mezza età.
Collins è entusiasta di avere finalmente una struttura definitiva per la telomerasi e non vede l'ora di saperne di più sull'intricato processo di assemblaggio di uno degli enzimi più complessi del corpo:una polimerasi complicata come il ribosoma, che legge l'RNA per produrre proteine.
"Non pensavo che sarebbe stato così complicato quando ho deciso di studiare questa molecola, " ha detto. "Sono diventata curiosa di sapere come funziona la telomerasi nel 1991, quando stavo finendo di diventare uno studente universitario, e stavo cercando un sistema di polimerasi davvero semplice in cui comprendere le interazioni degli acidi nucleici. E ho pensato, mio dio, non puoi essere più semplice di così. È stato super ingenuo".