Struttura megacomplessa respiratoria. Credito: Cellula (2017). DOI:10.1016/j.cell.2017.07.050
(Phys.org):pezzo per pezzo, lo schema circuitale per il trasporto degli elettroni nei mitocondri è ormai più vicino al completamento. Ogni nuova struttura ottenuta per uno qualsiasi dei cinque complessi respiratori limita ulteriormente il puzzle assemblato. Infine, i grandi blocchi sono disposti nei loro posizionamenti finali. L'esatta composizione del blocco più grande, il cosiddetto megacomplesso, è sfuggito a lungo ai ricercatori. Ora, dopo l'imaging di 140 singole subunità fino a una risoluzione di 3,9 anstrom, il Full Monty è stato messo a nudo. I ricercatori descrivono in Cellula esattamente come il megacomplesso respiratorio umano è messo insieme e sembra funzionare.
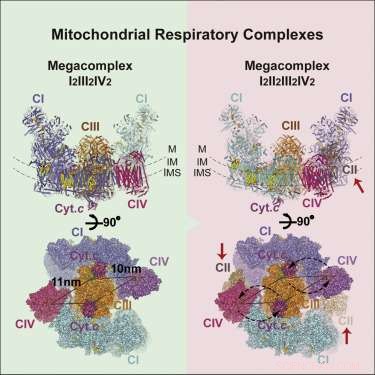
Sono finiti i giorni semplici. Non più diagrammi grezzi con complessi allineati nella membrana in fila da uno a cinque con elettroni e i loro vettori mobili che viaggiano in sequenza da sinistra a destra. Dai la stechiometria, e porta il 2-D. Stechiometria significa che in realtà, ogni complesso è effettivamente rappresentato nel megacomplesso con un numero di copia specifico. Queste copie extra devono andare da qualche parte in una rappresentazione accurata. Non solo quello, ma i portatori di elettroni più piccoli hanno bisogno di uno spazio per rilassarsi. Devono anche essere presenti all'interno di canali che rimangono locali al megacomplesso o eventualmente si diffondono ad altri. La geometria finale determinerà dove i percorsi degli elettroni separati si uniscono o si biforcano, e dove è più probabile che vadano al contrario.
Il quadro del megacomplesso (MC) emerso presenta la seguente stechiometria:MCI2II2III2IV2. Ciò significa che i complessi I, II, III, e IV sono presenti ciascuno in duplicato mentre il complesso V è assente. È configurato all'interno della membrana in una struttura circolare con il dimerico CIII situato al centro e alimentato dai complessi periferici CI e CIV. I complessi CII non sono apparentemente requisiti essenziali per la struttura centrale, ma piuttosto sono teorizzati per essere incastrati negli spazi vuoti secondo necessità. Gli autori hanno anche trovato prove per una resa leggera del megacomplesso che a volte può essere assemblato con un solo complesso CI.
Il posizionamento centrale del dimero CIV suggerisce una certa logica. CIV, o citocromo ossidasi, è il terreno terminale di appoggio per gli elettroni che entrano nella catena. Quelli che arrivano fino a questo punto sono stati abbassati nella gerarchia del potenziale di riduzione il più lontano possibile. Qui, sono sprofondati in molecole di ossigeno in attesa, che vengono poi esaurite come molecole d'acqua. Gli elettroni ad alto potenziale impacchettati come NADH entrano nel complesso dal suo perimetro e vengono incanalati nel centro. L'assenza di complessi C5 potrebbe non essere così insolita, considerando che si trovano tipicamente come file di dimeri a forma di "V" che contorcono la membrana in regioni di elevata curvatura in corrispondenza delle pieghe della cresta.
Con la struttura di base in mano, i ricercatori sono stati in grado di suggerire alcuni principi fondamentali di funzionamento. La loro inclusione e posizionamento di CII spiega efficacemente il trasporto inverso di elettroni dal succinato al NADH. La geometria proposta crea anche un Q-pool sigillato (un trasportatore di elettroni liposolubile) accessibile sia a CI che a CII. Gli autori sono stati anche in grado di individuare l'identità e le posizioni di diverse molecole lipidiche che fissano il complesso all'interno della membrana, nello specifico, diverse molecole chiave di fosfatidiletanolammina, fosfatidilcolina, e cardiolipina. Sono stati anche in grado di identificare percorsi di trasferimento di elettroni preferiti o più efficienti, che a loro volta vincolano quanti elettroni possono essere trasferiti simultaneamente tra portatori attivi.
Tra i vantaggi immediati di questo nuovo lavoro c'è il fatto che molte delle mutazioni patogene precedentemente comprese in modo incompleto nelle proteine respiratorie ora hanno un senso. Prima di avere una struttura megacomplessa, i ricercatori non hanno avuto altra scelta che concentrarsi su come le mutazioni influenzano la struttura o la funzione dei singoli complessi. Come risulta, la maggior parte delle mutazioni registrate nelle subunità core bersaglio Ci e CIII sono nei residui coinvolti nei siti di interazione proteina-proteina tra i complessi. (Per esempio, mutazioni associate alla malattia nelle subunità NDUFV1, NDUFS1, ND1, ND5, e ND6 in CI e subunità MT-CYB in CIII). Ciò mostra l'inutilità di cercare di guardare solo singole proteine e subunità in assenza del quadro più ampio.
Va detto che i precedenti sforzi per definire la stechiometria dei complessi respiratori hanno ottenuto risultati leggermente diversi a seconda di quali organi e specie sono stati studiati. Patata, mucca, pecora, e lievito, che non sempre hanno nemmeno un complesso di CI di cui parlare, sono stati tutti studiati. Non sorprende che circostanze diverse possano richiedere stechiometria e forma diverse. Diverse strutture megacomplesse comporterebbe diversi vantaggi per la canalizzazione del substrato, potenziamento catalitico, sequestro di intermedi reattivi, o stabilizzazione strutturale. Uno studio che ha esaminato specificamente i mitocondri cardiaci ha stabilito il rapporto per i complessi di fosforilazione ossidativa I:II:III:IV:V come 1:1,5:3:6:3. In questo caso, gli autori chiamavano il loro complesso il "respirasoma".
Con il megacomplesso respiratorio ora presumibilmente incrinato, il prossimo grande passo avanti è inserire alcune delle altre sovrastrutture del sistema mitocondriale a doppia membrana in modelli per prevedere perché la cristea ha l'aspetto che ha. I massicci complessi di importazione TIM-TOM attraversano entrambe le membrane e sono intimamente associati ai mitoribosomi che traducono le proteine mitocondriali. I mitoribosomi, a sua volta, sono localizzati nei nucleoidi associati alla membrana sottostante che ospitano copie del mtDNA. Per analogia con il nucleolo del nucleo, questa struttura composita nucleoide-ribosoma è stata chiamata "mitocondriolo". Per esempio, è la navetta più importante nel cervello ed equilibra i principali metaboliti tra mitocondri e citosol. La navetta citrato-piruvato per la sintesi degli acidi grassi e la navetta glicerolo fosfato (almeno per il grasso bruno e il muscolo di volo degli insetti) devono anche trovare case dove possono andare d'accordo con i vicini immediati.
L'organizzazione endemica delle proteine in queste megastrutture suggerisce che i mitocondri potrebbero assomigliare più a un cristallo duro che a un protoplasma fluido. Eppure in qualche modo, appaiono notevolmente flessibili quando si tratta di fusione e fissione. Cosa succede alla loro struttura a membrana sotto questo tipo di cambiamenti? I complessi sono temporaneamente smontati e solubilizzati come il ciglio e il centriolo primari delle cellule regolari durante la mitosi? Un nuovo affascinante indizio emerge dal lavoro che mostra che i mitocondri si connettono tra loro attraverso "nanotunnel" di loro stessa costruzione. Questi nanotunnel sono completamente diversi (per quanto ne sappiamo) dal marchio infuso di citoscheletro di "nanotubi tunnel" che le cellule stesse usano per trasferire interi mitocondri l'uno all'altro.
Una recente recensione di Martin Picard e dei suoi colleghi in Tendenze in biologia cellulare suggerisce un modo in cui questi nanotunnel potrebbero formarsi quando i mitocondri sono fissati al citoscheletro. Se le proteine motorie come la chinesina entrano in possesso di una porzione di un mitocondrio fisso, potrebbe tirare fuori un sottile nanotunnel mentre i motori della chinesina contro un altro microtubulo. Il corpo rigido dei mitocondri e la sua struttura a membrana rimarrebbero presumibilmente intatti. Questa proiezione potrebbe quindi incontrare un altro mitocondrio a cui si attacca.
Picard ha mostrato in precedenza che circa la metà dei mitocondri all'interno del muscolo cardiaco ha giunzioni intermitocondriali (IMJ) e creste che si allineano in schemi regolari che si estendono attraverso le reti mitocondriali. È improbabile che questo inquietante allineamento della rete derivi da recenti eventi di fissione perché i mitocondri del cuore sono fissati in posizione e mostrano dinamiche di fissione/fusione minime. È stato recentemente dimostrato che gli IMJ controllano la contrattilità disaccoppiando rapidamente i mitocondri quando le loro stesse membrane sono depolarizzate. Una cosa che sarebbe di interesse immediato, qui, consiste nel riesaminare la stechiometria della subunità respiratoria nei mitocondri del cuore umano per completare i risultati riportati qui per le cellule renali embrionali umane.
© 2017 Phys.org